题目内容
19.下列说法不正确的是( )| A. | pH=7的溶液不一定是中性溶液 | |
| B. | 0.2 mol•L-1的盐酸与等体积水混合后pH=1(体积变化忽略不计) | |
| C. | 能自发进行的化学反应,一定是△H<0、△S>0 | |
| D. | NaNO2固体溶于水会促进水的电离(已知Ka(HNO2)=4.6×10-4) |
分析 A、温度会影响pH,据此回答判断;
B、计算混合溶液中氢离子浓度得到溶液PH;
C、根据△G=△H-T•△S<0反应能自发进行判断;
D、能水解的离子对水的电离平衡起到促进作用.
解答 解:A、常温时,pH=7,为中性,而温度升高,pH=7可能为碱性,故A正确;
B、0.2 mol•L-1的盐酸与等体积水混合后,忽略体积的变化,溶液中氢离子浓度=0.1mol/L,溶液pH=1,故B正确;
C、△G=△H-T•△S<0反应能自发进行,△H<0、△S>0,如在温度较低的情况下,则反应不能自发进行,故C错误;
D、NaNO2固体溶于水电离出来的亚硝酸根离子可以发生水解反应,会促进水的电离,故D正确.
故选C.
点评 本题考查了水的电离平衡影响因素,溶液pH计算,化学反应的方向等知识,题目难度中等.

练习册系列答案
 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
10.A的分子式为C8H16O2,可发生如下转化: ,其中B与E互为同分异构体,则A可能的结构有( )
,其中B与E互为同分异构体,则A可能的结构有( )
 ,其中B与E互为同分异构体,则A可能的结构有( )
,其中B与E互为同分异构体,则A可能的结构有( )| A. | 2种 | B. | 6种 | C. | 8种 | D. | 4种 |
14.下列说法正确的是( )
| A. | 煤经气化或液化这两个化学变化过程都可以转变为清洁能源 | |
| B. | 石油裂解目的是提高汽油的质量和产量 | |
| C. | 绿色食品是指不含任何化学物质的食品 | |
| D. | 乙烯和苯均能发生氧化反应,说明两者都有碳碳双键 |
4.化学平衡常数K的数值大小是衡量化学反应进行程度的标志,在常温下,下列反应的平衡常数数值如下,以下说法不正确的是( )
2NO(g)?N2(g)+O2(g) K1=1×1030;
2H2(g)+O2(g)?2H2O(g) K2=2×1081;
2CO2(g)?2CO(g)+O2(g) K3=4×10-92.
2NO(g)?N2(g)+O2(g) K1=1×1030;
2H2(g)+O2(g)?2H2O(g) K2=2×1081;
2CO2(g)?2CO(g)+O2(g) K3=4×10-92.
| A. | 升温时,三个反应的反应物的活化分子百分数均增加 | |
| B. | 常温下,水分解产生O2,此时平衡常数的数值约为5×10-80 | |
| C. | 常温下,NO、H2O、CO2三种化合物分解放出O2的倾向由大到小的顺序为NO>H2O>CO2 | |
| D. | 降温时,三个反应的化学反应速率均减慢 |
11.下列有关说法正确的是( )
| A. | NH4Cl(s)=NH3(g)+HCl(g)室温下不能自发进行,说明该反应的△H<0 | |
| B. | 镀锡铁制品镀层破损后,铁制品比受损前更容易生锈,而镀锌铁制品则相反 | |
| C. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,平衡时氢气转化率增大 | |
| D. | 给0.1mol•L-1CH3COOH溶液中加热,则c(H+)与c(CH3COOH)的比值增大 |
9.中国环境监测数据显示,颗粒物(PM2.5等)为雾霾过程中影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:
Ⅰ.改变煤的利用方式可减少环境污染,通常可将水蒸气通过红热的碳得到水煤气.
(1)煤气化过程中产生的有害气体H2S可用足量的Na2CO3溶液吸收,该反应的离子方程式为CO32-+H2S=HCO3-+HS-
(已知:H2S:Ka1=1.3×10-7,Ka2=7.1×10-15;H2CO3:Ka1=4.4×10-7,Ka2=4.7×10-11)
(2)现将不同量的CO(g)和H2O(g)分别通人到体积为2L的恒容密闭容器中发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H,得到两组数据
该反应的△H<0(填“<”或“>”);若在7500C时,另做一组实验,在2L的恒容密闭容器中加入lmol CO,3mo1H2O,2mo1CO2,5mol H2,则此时?正<?逆(填“<”,“>”,“=”).
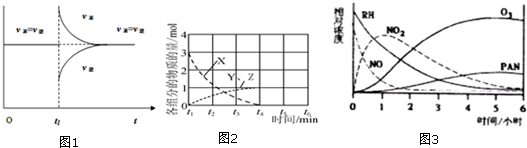
(3)一定条件下,某密闭容器中已建立A(g)+B(g)?C(g)+D(g)△H>0的化学平衡,其时间速率图象如图1,下列选项中对于t1时刻采取的可能操作及其平衡移动情况判断正确的是A
A.减小压强,同时升高温度,平衡正向移动
B.增加A(g)浓度,同时降低温度,平衡不移动
C.保持容器温度压强不变通入稀有气体,平衡不移动
Ⅱ.压缩天然气(CNG)汽车的优点之一是利用催化技术将NOx转变成无毒的CO2和N2.
①CH4(g)+4NO(g)$\stackrel{催化剂}{?}$2N2(g)+CO2(g)+2H2O(g)△H1<0
②CH4(g)+2NO2(g)$\stackrel{催化剂}{?}$2N2(g)+CO2(g)+2H2O(g)△H2<0
(4)收集某汽车尾气经测量NOx的含量为1.12%(体积分数),若用甲烷将其完全转化为无害气体,处理1×104L(标准状况下)该尾气需要甲烷30g,则尾气中V (NO):V (NO2)=1:1.
(5)在不同条件下,NO的分解产物不同.在高压下,NO(即X)在40℃下分解生成两种化合物(即Y、Z),体系中各组分物质的量随时间变化曲线如图2所示.写出Y和Z的化学式:N2O、NO2
(6)某研究性学习小组,为研究光化学烟雾消长
规律,在一烟雾实验箱中,测得烟雾的主要成分为RH(烃)、NO、NO2、O3、PAN(CH3COOONO2),各种物质的相对浓度随时间的消失,记录于图3,根据图中数据,下列推论,最不合理的是D
A.NO的消失的速率比RH快
B.NO生成NO2
C.RH及NO2可以生成PAN及O3
D.O3生成PAN
Ⅰ.改变煤的利用方式可减少环境污染,通常可将水蒸气通过红热的碳得到水煤气.
(1)煤气化过程中产生的有害气体H2S可用足量的Na2CO3溶液吸收,该反应的离子方程式为CO32-+H2S=HCO3-+HS-
(已知:H2S:Ka1=1.3×10-7,Ka2=7.1×10-15;H2CO3:Ka1=4.4×10-7,Ka2=4.7×10-11)
(2)现将不同量的CO(g)和H2O(g)分别通人到体积为2L的恒容密闭容器中发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H,得到两组数据
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡 所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
(3)一定条件下,某密闭容器中已建立A(g)+B(g)?C(g)+D(g)△H>0的化学平衡,其时间速率图象如图1,下列选项中对于t1时刻采取的可能操作及其平衡移动情况判断正确的是A
A.减小压强,同时升高温度,平衡正向移动
B.增加A(g)浓度,同时降低温度,平衡不移动
C.保持容器温度压强不变通入稀有气体,平衡不移动
Ⅱ.压缩天然气(CNG)汽车的优点之一是利用催化技术将NOx转变成无毒的CO2和N2.
①CH4(g)+4NO(g)$\stackrel{催化剂}{?}$2N2(g)+CO2(g)+2H2O(g)△H1<0
②CH4(g)+2NO2(g)$\stackrel{催化剂}{?}$2N2(g)+CO2(g)+2H2O(g)△H2<0
(4)收集某汽车尾气经测量NOx的含量为1.12%(体积分数),若用甲烷将其完全转化为无害气体,处理1×104L(标准状况下)该尾气需要甲烷30g,则尾气中V (NO):V (NO2)=1:1.
(5)在不同条件下,NO的分解产物不同.在高压下,NO(即X)在40℃下分解生成两种化合物(即Y、Z),体系中各组分物质的量随时间变化曲线如图2所示.写出Y和Z的化学式:N2O、NO2
(6)某研究性学习小组,为研究光化学烟雾消长
规律,在一烟雾实验箱中,测得烟雾的主要成分为RH(烃)、NO、NO2、O3、PAN(CH3COOONO2),各种物质的相对浓度随时间的消失,记录于图3,根据图中数据,下列推论,最不合理的是D
A.NO的消失的速率比RH快
B.NO生成NO2
C.RH及NO2可以生成PAN及O3
D.O3生成PAN

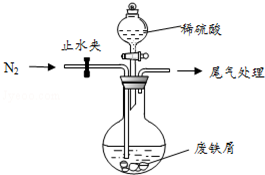 医疗上绿矾(FeSO4•7H2O)是治疗缺铁性贫血的特效药.某化学兴趣小组对绿矾进行了如下的探究:
医疗上绿矾(FeSO4•7H2O)是治疗缺铁性贫血的特效药.某化学兴趣小组对绿矾进行了如下的探究:
 .
.