题目内容
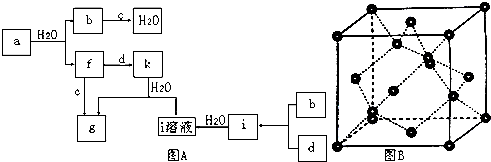
图A所示的转化关系中(具体反应条件略),a、b、c和d分别为四种短周期元素的常见单质,其余均为它们的化合物,i的溶液为常见的酸,f是无色无味的剧毒气体,a的一种同素异形体的晶胞如图B所示.
回答下列问题:
(1)图B对应的物质名称是 ,其晶胞中的原子数为 ,晶体类型为 .
(2)d中元素的原子核外电子排布式为 .
(3)图A中由二种元素组成的物质中,沸点最高的是 ,原因是 ,该物质的分子构型为 .
(4)图A中的双原子分子中,极性最大的分子是 .
(5)k的分子式为 ,属于 分子(填“极性”或“非极性”).

回答下列问题:
(1)图B对应的物质名称是
(2)d中元素的原子核外电子排布式为
(3)图A中由二种元素组成的物质中,沸点最高的是
(4)图A中的双原子分子中,极性最大的分子是
(5)k的分子式为
考点:无机物的推断,晶胞的计算
专题:推断题,化学键与晶体结构
分析:a、b、c和d分别为四种短周期元素的常见单质,b与c反应生成水,故b、c分别为H2、O2中的一种,a的一种同素异形体的晶胞中每个原子周围有4个键,判断为金刚石,则a为C,故b为H2、c为O2,由转化关系可知,f为CO,g为CO2,因i是常见的酸,只由b、d形成可判断为盐酸,则d为Cl2,i为HCl,而k与水反应生成CO2与盐酸,该反应没在教材中出现过,且由f、d反应得到,应含C、O、Cl三种元素,只能判断为COCl2,据此解答.
解答:
解:a、b、c和d分别为四种短周期元素的常见单质,b与c反应生成水,故b、c分别为H2、O2中的一种,a的一种同素异形体的晶胞中每个原子周围有4个键,判断为金刚石,则a为C,则b为H2、c为O2,由转化关系可知,f为CO,g为CO2,因i是常见的酸,只由b、d形成可判断为盐酸,则d为Cl2,i为HCl,而k与水反应生成CO2与盐酸,该反应没在教材中出现过,且由f、d反应得到,应含C、O、Cl三种元素,只能判断为COCl2,
(1)有上述分析可知,图B对应的位置为金刚石,该晶胞中C原子数目=4+8×
+6×
=8,属于原子晶体,
故答案为:金刚石;8;原子晶体;
(2)d中元素为Cl元素,基态原子电子排布式为1s22s22p63s23p5,故答案为:1s22s22p63s23p5;
(3)所有两元素形成的物质中,水分子之间存在氢键,常温下是液态,其它都是气体,故水的沸点最高,水分子中O原子呈2个σ键、含有2对孤电子对,故为V型结构,
故答案为:H2O;分子间形成氢键;V型;
(4)所有双原子分子中,只有H、Cl电负性差值最大,因而HCl的极性最大,故答案为:HCl;
(5)k的分子式为COCl2,COCl2中C原子成3个σ键、1个π键,没有孤电子对,C原子采取sp2杂化,为平面三角形结构,分子中正负电荷中心不重合,属于极性分子,
故答案为:COCl2;极性.
(1)有上述分析可知,图B对应的位置为金刚石,该晶胞中C原子数目=4+8×
| 1 |
| 8 |
| 1 |
| 2 |
故答案为:金刚石;8;原子晶体;
(2)d中元素为Cl元素,基态原子电子排布式为1s22s22p63s23p5,故答案为:1s22s22p63s23p5;
(3)所有两元素形成的物质中,水分子之间存在氢键,常温下是液态,其它都是气体,故水的沸点最高,水分子中O原子呈2个σ键、含有2对孤电子对,故为V型结构,
故答案为:H2O;分子间形成氢键;V型;
(4)所有双原子分子中,只有H、Cl电负性差值最大,因而HCl的极性最大,故答案为:HCl;
(5)k的分子式为COCl2,COCl2中C原子成3个σ键、1个π键,没有孤电子对,C原子采取sp2杂化,为平面三角形结构,分子中正负电荷中心不重合,属于极性分子,
故答案为:COCl2;极性.
点评:本题考查无机物推断、物质结构与性质,涉及杂化方式、晶体结构、分子极性、核外电子排布、分子构型等知识,关键根据晶胞结构判断b,难度中等.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
下列有机物中没有同分异构体的是( )
| A、溴乙烷 | B、二溴乙烷 |
| C、已烯 | D、二甲苯 |
下列物质的水溶液因发生水解而显酸性的是( )
| A、NH4Cl |
| B、KHSO4 |
| C、NaHCO3 |
| D、H2SO4 |
化学与社会、生产、生活紧切相关.下列说法正确的是( )
| A、PM2.5颗粒直径约是原子直径的2.5倍 |
| B、淀粉、蔗糖、氨基酸在一定条件都能发生水解反应 |
| C、植物油通常能和氢氧化钠溶液发生反应 |
| D、应该倡议禁止向绿色食品中添加任何化学物质 |
 有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,其中B是地壳中含量最多的元素.已知A、C及B、D分别是同主族元素,且B、D两元素原子核内质子数之和是A、C两元素原子核内质子数之和的2倍;在处于同周期的C、D、E三种元素中,E的原子半径最小;通常条件下,五种元素的单质中有三种气体,两种固体.
有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,其中B是地壳中含量最多的元素.已知A、C及B、D分别是同主族元素,且B、D两元素原子核内质子数之和是A、C两元素原子核内质子数之和的2倍;在处于同周期的C、D、E三种元素中,E的原子半径最小;通常条件下,五种元素的单质中有三种气体,两种固体.