题目内容
16.根据反应8NH3+3Cl2→6NH4Cl+N2回答下列问题:①氧化剂是Cl2 还原剂是NH3 氧化剂与还原剂物质的量之比是3:2;
②标出电子转移的方向及数目 8NH3+3Cl2→6NH4Cl+N2
③当有1.806个电子转移,则生成的气体在标准状况下的体积是11.2L.
分析 反应8NH3+3Cl2═6NH4Cl+N2,N元素的化合价升高,Cl元素的化合价降低,该反应中转移6e-,以此来解答.
解答 解:(1)该反应中N元素化合价由-3价变为0价、Cl元素化合价由0价变为-1价,所以NH3是还原剂,其中只有部分氨气是还原剂、Cl2是氧化剂,氧化剂与还原剂物质的量之比是3:2,故答案为:Cl2;NH3;3:2;
(2)反应中N元素的化合价由-3升高为0,Cl元素的化合价0降低为-1价,2molNH3作还原剂转移电子为6mol,则反应电子转移的方向和数目为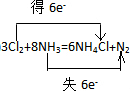 ,故答案为:
,故答案为: ;
;
(3)由反应可知,生成1mol氮气转移6mol电子,当反应中转移1.806×1024个电子时,当有1.806个电子转移即转移电子的物质的量为:$\frac{1.806×1{0}^{24}}{6.02×1{0}^{23}}$=3mol,所以生成氮气为0.5mol,则生成的气体在标准状况下的体积是0.5mol×22.4L/mol=11.2L,
故答案为:11.2.
点评 本题考查氧化还原反应,为高考高频考点,把握发生的化学反应及反应中元素的化合价变化为解答的关键,侧重基本概念和转移电子的考查,题目难度不大.

练习册系列答案
相关题目
6.一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体V L(标准状况),向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0g,若上述气体为NO和NO2的混合物,且体积比为1:1,则V可能为( )
| A. | 7.5 L | B. | 12.3 L | C. | 15.7 L | D. | 16.8 L |
4.同温同压下,甲乙两容器分别装有CH4和NH3气体,已知它们所含原子数相同,则甲乙两容器体积比为( )
| A. | 4:3 | B. | 4:5 | C. | 5:4 | D. | 1:1 |
11.下列对离子化合物的叙述正确的是( )
①离子化合物一定是含有离子键的化合物
②离子化合物一定是由金属元素和非金属元素组成
③离子化合物熔点高,加热一定难分解
④化合物在液态时导电的是离子化合物,不导电的是共价化物.
①离子化合物一定是含有离子键的化合物
②离子化合物一定是由金属元素和非金属元素组成
③离子化合物熔点高,加热一定难分解
④化合物在液态时导电的是离子化合物,不导电的是共价化物.
| A. | ①④ | B. | ②③ | C. | ①④②③ | D. | ①②③ |
1.0.5L 2mol/L FeCl3溶液与0.2L 5mol/L KCl溶液中的Cl-物质的量之比( )
| A. | 6:5 | B. | 3:2 | C. | 15:2 | D. | 3:1 |
8.25℃时,水的电离达到平衡:H2O?H++OH-,下列叙述正确的是( )
| A. | 向水中加入稀氨水,平衡逆向移动,c(OH-)减小 | |
| B. | 向水中加入少量固体硫酸氢钠,c(H+)不变,KW不变 | |
| C. | 增大水的体积,则水中 n(H+) 与n(OH-) 乘积变大 | |
| D. | 将水加热,KW增大,pH不变 |
6.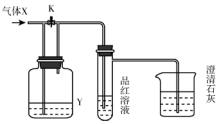 如图是一套检验气体性质的实验装置.向装置中缓缓通入气体X,若关闭活塞K,则品红溶液褪色.据此判断气体X和洗气瓶内的溶液Y可能的组合是( )
如图是一套检验气体性质的实验装置.向装置中缓缓通入气体X,若关闭活塞K,则品红溶液褪色.据此判断气体X和洗气瓶内的溶液Y可能的组合是( )
 如图是一套检验气体性质的实验装置.向装置中缓缓通入气体X,若关闭活塞K,则品红溶液褪色.据此判断气体X和洗气瓶内的溶液Y可能的组合是( )
如图是一套检验气体性质的实验装置.向装置中缓缓通入气体X,若关闭活塞K,则品红溶液褪色.据此判断气体X和洗气瓶内的溶液Y可能的组合是( )| A | B | C | D | |
| X | 硫化氢 | 二氧化硫 | 二氧化碳 | 氯化氢 |
| Y | 浓硫酸 | 饱和NaHCO3 | Na2SO3溶液 | 饱和NaHSO3 |
| A. | A | B. | B | C. | C | D. | D |