题目内容
8.25℃时,水的电离达到平衡:H2O?H++OH-,下列叙述正确的是( )| A. | 向水中加入稀氨水,平衡逆向移动,c(OH-)减小 | |
| B. | 向水中加入少量固体硫酸氢钠,c(H+)不变,KW不变 | |
| C. | 增大水的体积,则水中 n(H+) 与n(OH-) 乘积变大 | |
| D. | 将水加热,KW增大,pH不变 |
分析 水是弱电解质,存在电离平衡,向水中加入含有氢离子或氢氧根离子的物质抑制水电离,加入含有弱根离子的盐促进水电离,水的离子积常数只与温度有关,与溶液的酸碱性无关.
解答 解:A.向水中加入稀氨水,导致溶液中氢氧根离子浓度增大,抑制水电离,氢氧根离子浓度增大,故A错误;
B.向水中加入少量硫酸氢钠,导致溶液中氢离子浓度增大,但温度不变,水的离子积常数不变,故B错误;
C.增加水的量,氢离子和氢氧根离子浓度不变且相等,平衡不移动,水中 n(H+) 与n(OH-) 乘积变大,故C正确;
D.将水加热促进水电离,离子积常数增大,氢离子浓度增大,pH减小,故D错误;
故选C.
点评 本题考查了影响水电离平衡的因素,明确温度对水的电离的影响及温度与离子积的关系,注意硫酸氢钠电离出氢离子,为易错点,题目难度不大.

练习册系列答案
相关题目
18.将5gAl、Al2O3、Al(OH)3的混合物与200g4.9%的稀硫酸混合,恰好完全反应.将反应后的溶液蒸干后,最终得到固体的质量是( )
| A. | 11.4g | B. | 14.8g | C. | 205g | D. | 无法计算 |
13.NA代表阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 标准状况下,S2和S8的固体混合物共6.4g,其中所含硫原子数一定为0.2NA | |
| B. | 将1molFeCl3滴入足量沸水中,所分散系中粒子数目小于NA | |
| C. | 6.4g铜与硫反应时,铜失去的电子数为0.2NA | |
| D. | 标准状况下,44.8L NO与22.4L O2混合后气体中分子总数为2NA |
20.设NA为阿伏加德罗常数,以下说法正确的是( )
| A. | 标准状况下,22.4 L乙醇中分子数为NA | |
| B. | 含有NA个氦原子的氦气在标准状况下的体积约为22.4L | |
| C. | 1.8g的NH4+中含有的电子数为1.1NA | |
| D. | 在1 L 2 mol/L的盐酸中,存在2NA个氯化氢分子 |
17.下列实验原理,操作或装置(略去部分夹持仪器)正确的是( )
| A. |  配制溶液 | B. |  中和滴定 | ||
| C. |  除去溴苯中少量的溴单质 | D. |  制取并收集氨气 |
18.下列实验方案合理的是( )
| A. | 检验溶液中的SO42-,加入HCl酸化的Ba(NO3)2溶液,观察有无白色沉淀生成 | |
| B. | 除去NO中混有的少量NO2,将混合气体通入水中,再用排空气法收集NO | |
| C. | 用NaNO3固体与浓硫酸微热制HNO3 | |
| D. | 通入CO2以除去Na2CO3溶液中混有的NaHCO3 |
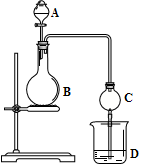 化学实验中,同一个装置可以用于不同的实验,例如图的实验装置(B中可为固体或液体,可加热).
化学实验中,同一个装置可以用于不同的实验,例如图的实验装置(B中可为固体或液体,可加热).