题目内容
18.求下列粒子的物质的量(1)含4molO原子的H2SO4的物质的量1mol
(2)含6.02x1023个电子的H2O的物质的量0.1mol
(3)标准状况下,11.2LH2的物质的量0.5mol
(4)1.5molH2SO4其中含有6 molO,含有3 molH.
分析 (1)根据硫酸的化学式组成计算出硫酸的物质的量;
(2)6.02×1023个电子的物质的量为1mol,结合水分子含有10个电子计算水的物质的量;
(3)根据n=$\frac{V}{{V}_{m}}$计算氢气的物质的量;
(4)根据硫酸分子的化学式组成计算出含有O、H原子的物质的量.
解答 解:(1)H2SO4中含有4个O原子,含4molO原子的H2SO4的物质的量为:$\frac{4mol}{4}$=1mol,
故答案为:1mol;
(2)6.02×1023个电子的物质的量为1mol,需要水的物质的量为:$\frac{1mol}{10}$=0.1mol,
故答案为w:0.1mol;
(3)标准状况下11.2LH2的物质的量为:$\frac{11.2L}{22.4L/mol}$=0.5mol,
故答案为:0.5mol;
(4)1.5molH2SO4其中含O的物质的量为:1.5mol×4=6mol,含有H的物质的量为:1.5mol×2=3mol,
故答案为:6;3.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与阿伏伽德罗常数、气体摩尔体积之间的关系即可解答,试题有利于提高学生的化学计算能力.

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
8.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 65gKHSO4晶体中含有SO42-的数目为0.5NA | |
| B. | 把含0.1molFeCl3的浓溶液加入沸水中形成0.1NA个氢氧化铁胶体 | |
| C. | 常温常压下,7.0g乙烯与丙烯的混合物中含有碳氢键的数目为NA | |
| D. | 50mL18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA |
6.硫酸铝、硫酸钾、明矾三种物质组成的混合物中,当SO42-的浓度为0.20mol•L-1时,加入等体积的0.20mol•L-1的KOH溶液(混合后溶液体积变化忽略不计),使生成的白色沉淀恰好溶解,那么最后混合物中K+的浓度是( )
| A. | 0.20 mol•L-1 | B. | 0.25 mol•L-1 | C. | 0.225 mol•L-1 | D. | 0.45 mol•L-1 |
13.下列各组分子中,都属于含有极性键的非极性分子的是( )
| A. | CO2、H2S | B. | H2O2、C3H6 | C. | C2H4、CH4 | D. | NH3、HCl |
3.下列溶液中微粒的物质的量浓度关系正确的是( )
| A. | 0.1mol/LNaHCO3溶液:c(Na+)>c(OH-)>c(HCO3-)>c(H+) | |
| B. | 室温下,向0.01mol/LNH4HSO4溶液中滴加等体积0.01mol/LNaOH溶液:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | Na2CO3溶液:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-) | |
| D. | 25℃时,浓度均为0.1mol/L的CH3COOH和CH3COONa等体积混合:c(CH3COOH)+c(CH3COO-)=0.2mol/L |
7.下列关于电解质溶液的叙述不正确的是( )
| A. | pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈紫色 | |
| B. | 在pH=3 的溶液中,Na+、Cl-、Fe2+、ClO-不能大量共存 | |
| C. | 常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Clˉ)=c(NH4+)>c(H+)=c(OHˉ) | |
| D. | 向0.1mol•L-1的氨水中加入少量硫酸铵固体,则溶液中c(OH-)/c(NH3•H2O)减小 |
8.用电解法出去碱性溶液中的尿素[CO(NH2)2],装置如图所示(隔膜仅阻止气体通过,且a、b极均为惰性电极).下列说法错误的是( )
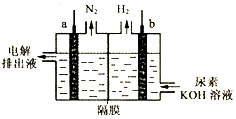

| A. | 电极b与外电源的负极相连 | |
| B. | 电解时,OH-、尿素分子均可穿过隔膜进入左室 | |
| C. | a极反应式为:CO(NH2)2-6e-+H2O═CO2↑+N2↑+6H+ | |
| D. | 每消耗1g尿素则产生标准状况下1.12LH2 |