题目内容
8.设NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 65gKHSO4晶体中含有SO42-的数目为0.5NA | |
| B. | 把含0.1molFeCl3的浓溶液加入沸水中形成0.1NA个氢氧化铁胶体 | |
| C. | 常温常压下,7.0g乙烯与丙烯的混合物中含有碳氢键的数目为NA | |
| D. | 50mL18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA |
分析 A.硫酸氢钾晶体中含有钾离子和硫酸氢根离子;
B.胶体微粒是多个粒子集合体;
C.乙烯和丙烯均由CH2构成;
D.铜只能与浓硫酸反应,与稀硫酸不反应;
解答 解:A.硫酸氢钾晶体中不含硫酸根离子,故A错误;
B.胶体微粒是多个粒子集合体,所以把含0.1molFeCl3的浓溶液加入沸水中形成小于0.1NA个氢氧化铁胶体,故B错误;
C.乙烯和丙烯均由CH2构成,故7.0g混合物中含有的CH2的物质的量n=$\frac{7g}{14g/mol}$=0.5mol,故含有1molC-H键即NA个,故C正确;
D.铜只能与浓硫酸反应,与稀硫酸不反应,故硫酸不能反应完全,则生成的二氧化硫分子个数小于0.46NA个,故D错误;
故选:C.
点评 本题考查了阿伏伽德罗常数的分析判断,主要是气体摩尔体积的条件应用,有机物结构的分析,微粒数的计算应用,掌握基础是解题关键,题目难度中等.

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目
19.某无色透明溶液中存在大量的H+、Cl-、NO3-,该溶液中还可能大量存在的是( )
| A. | HCO3- | B. | Cu2+ | C. | NH4+ | D. | Ag+ |
16.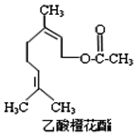 乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中不正确的是( )
乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中不正确的是( )
①分子式为C12H20O2
②能使酸性KMnO4溶液褪色,但不能使溴水褪色
③能发生的反应类型有:加成、取代、氧化、加聚
④它的同分异构体中可能有芳香族化合物
⑤1mol该有机物水解时只能消耗1molNaOH
⑥1mol该有机物在一定条件下和H2反应,共消耗H2为3mol.
 乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中不正确的是( )
乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中不正确的是( ) ①分子式为C12H20O2
②能使酸性KMnO4溶液褪色,但不能使溴水褪色
③能发生的反应类型有:加成、取代、氧化、加聚
④它的同分异构体中可能有芳香族化合物
⑤1mol该有机物水解时只能消耗1molNaOH
⑥1mol该有机物在一定条件下和H2反应,共消耗H2为3mol.
| A. | ①②③ | B. | ①②⑤ | C. | ②④⑥ | D. | ②⑤⑥ |
3.现有短周期元素X、Y、Z、M,已知X、Y位于同主族,Z、M位于同主族,Y、Z位于同周期,X与Z、M都不在同一周期,Z的核电荷数是M的2倍.下列说法正确的是( )
| A. | 简单阳离子的氧化性:Y>X | |
| B. | 气态氢化物的稳定性:Z>M | |
| C. | 简单离子半径由大到小的顺序是Z>Y>M | |
| D. | X与Z可以形成原子个数比1:1的化合物 |
17.原子序数依次增大的短周期主族元素a、b、c、d,它们的最外层电子数分别为4、1、x、7,c原子的电子层数等于x,d-的电子层结构与氩相同.下列说法错误的是( )
| A. | a与氢元素能形成原子个数之比为1:1的化合物 | |
| B. | b单质能与水、无水乙醇反应 | |
| C. | c3+与d-的最外层电子数和电子层数都不相同 | |
| D. | a与d可形成含有极性共价键的化合物 |
 实验室需要配制100mL 0.1mol•L-1 CuSO4溶液.
实验室需要配制100mL 0.1mol•L-1 CuSO4溶液. 某品牌果冻标签如图所示.回答下列问题:
某品牌果冻标签如图所示.回答下列问题: