题目内容
已知X、Y、Z、W、T是短周期中原子序数依次增大的5种主族元素.其中Y和X两种元素可以组成1:1、1:2、1:3、1:4等多种化合物; Z原子最外层电子数是次外层电子数的3倍,W与X同主族,W与T形成的化合物WT是厨房必需的调味品.下列说法正确的是( )
| A、原子半径:T>W>Z>Y |
| B、W与T的单质可通过电解饱和的WT水溶液获得 |
| C、Z与W形成的两种化合物中化学键类型完全相同 |
| D、元素X、Z与T可形成多种酸 |
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X、Y、Z、W、T是短周期中原子序数依次增大的5种主族元素,Z原子最外层电子数是次外层电子数的3倍,最外层电子数不超过8个,K层为最外层不超过2个,所以Z原子次外层为K层,其最外层有6个电子,为O元素;
其中Y和X两种元素可以组成1:1、1:2、1:3、1:4等多种化合物,且X原子序数最小,为H元素,Y为C元素;
W与X同主族,且原子序数大于Z,所以W为Na元素,W与T形成的化合物WT是厨房必需的调味品,则T为Cl元素,
A.原子电子层数越多,其原子半径越大,同一周期元素原子半径随着原子序数增大而减小;
B.W与T的单质分别是Na、Cl2,Na属于活泼金属,应该电解熔融NaCl得到氯气和钠;
C.Z与W形成的两种化合物分别是Na2O、Na2O2,两种物质中化学键类型不完全相同;
D.在含氧酸中Cl元素化合价可能为+1价、+5价、+7价等,所以元素H、O、Cl可以形成多种含氧酸.
其中Y和X两种元素可以组成1:1、1:2、1:3、1:4等多种化合物,且X原子序数最小,为H元素,Y为C元素;
W与X同主族,且原子序数大于Z,所以W为Na元素,W与T形成的化合物WT是厨房必需的调味品,则T为Cl元素,
A.原子电子层数越多,其原子半径越大,同一周期元素原子半径随着原子序数增大而减小;
B.W与T的单质分别是Na、Cl2,Na属于活泼金属,应该电解熔融NaCl得到氯气和钠;
C.Z与W形成的两种化合物分别是Na2O、Na2O2,两种物质中化学键类型不完全相同;
D.在含氧酸中Cl元素化合价可能为+1价、+5价、+7价等,所以元素H、O、Cl可以形成多种含氧酸.
解答:
解:X、Y、Z、W、T是短周期中原子序数依次增大的5种主族元素,Z原子最外层电子数是次外层电子数的3倍,最外层电子数不超过8个,K层为最外层不超过2个,所以Z原子次外层为K层,其最外层有6个电子,为O元素;
其中Y和X两种元素可以组成1:1、1:2、1:3、1:4等多种化合物,且X原子序数最小,为H元素,Y为C元素;
W与X同主族,且原子序数大于Z,所以W为Na元素,W与T形成的化合物WT是厨房必需的调味品,则T为Cl元素,
A.T是Cl元素、W是Na元素、Z是O元素、Y为C元素,所以原子半径W>T>Y>Z,故A错误;
B.W与T的单质分别是Na、Cl2,Na属于活泼金属,应该电解熔融NaCl得到氯气和钠,如果电解NaCl溶液,阴极上氢离子放电生成氢气,所以得不到Na,故B错误;
C.Z与W形成的两种化合物分别是Na2O、Na2O2,Na2O中只含离子键、Na2O2中含有离子键和非极性键,所以化学键类型不完全相同,故C错误;
D.在含氧酸中Cl元素化合价可能为+1价、+5价、+7价等,所以元素H、O、Cl可以形成多种含氧酸,如HClO、HClO3、HClO4等,故D正确;
故选D.
其中Y和X两种元素可以组成1:1、1:2、1:3、1:4等多种化合物,且X原子序数最小,为H元素,Y为C元素;
W与X同主族,且原子序数大于Z,所以W为Na元素,W与T形成的化合物WT是厨房必需的调味品,则T为Cl元素,
A.T是Cl元素、W是Na元素、Z是O元素、Y为C元素,所以原子半径W>T>Y>Z,故A错误;
B.W与T的单质分别是Na、Cl2,Na属于活泼金属,应该电解熔融NaCl得到氯气和钠,如果电解NaCl溶液,阴极上氢离子放电生成氢气,所以得不到Na,故B错误;
C.Z与W形成的两种化合物分别是Na2O、Na2O2,Na2O中只含离子键、Na2O2中含有离子键和非极性键,所以化学键类型不完全相同,故C错误;
D.在含氧酸中Cl元素化合价可能为+1价、+5价、+7价等,所以元素H、O、Cl可以形成多种含氧酸,如HClO、HClO3、HClO4等,故D正确;
故选D.
点评:本题涉及化学键、金属冶炼、原子半径比较等知识点,综合性较强,侧重考查基本理论,会根据金属活泼性强弱确定金属冶炼方法,熟练掌握物质结构、原子结构,知道过氧化钠中存在的化学键并会书写其电子式.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
A、B、C短周期元素在周期表中的位置如图所示,已知A、C可分别与B形成化合物X和Y,A与B的质子数之和等于C的质子数,现有以下说法,判断正确的是( )
| A | B |
| C |
| A、B形成的单质存在同素异形体,C的单质不存在同素异形体 |
| B、C的最高价氧化物对应的水化物能与A的常见氢化物形成三种盐 |
| C、常温下,B的氢化物中无H+ |
| D、Y的种类比X多 |

 、
、 外,其余的结构简式为
外,其余的结构简式为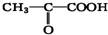 ),由以上事实推知乳酸的结构简式为
),由以上事实推知乳酸的结构简式为
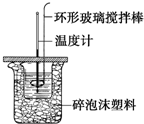 利用如图所示装置测定中和热的实验步骤如下:
利用如图所示装置测定中和热的实验步骤如下: