题目内容
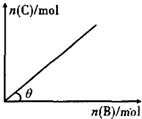 一定条件下,恒容的密闭容器中,加人一定量的A与B发生反应A(s)+2B(g)?C(g)+2D(g)△H<0,平衡时C的物质的量与加入B的物质的量的变化关系如图所示.下列说法正确的是( )
一定条件下,恒容的密闭容器中,加人一定量的A与B发生反应A(s)+2B(g)?C(g)+2D(g)△H<0,平衡时C的物质的量与加入B的物质的量的变化关系如图所示.下列说法正确的是( )| A、增加A的物质的量,正反应速率加快 |
| B、平衡时,其他条件不变,当温度升高时,θ变大 |
| C、图中曲线的斜率表示反应的化学平衡常数 |
| D、平衡时,其他条件不变,再通入B,则反应混合物的温度升高 |
考点:化学平衡的影响因素,化学平衡建立的过程
专题:化学平衡专题
分析:A、由于A是固体,增加A的量不影响化学反应速率;
B、平衡时,其他条件不变,当温度升高时,平衡向逆反应方向移动;
C、温度一定时,化学平衡常数是定值,结合平衡常数计算式分析;
D、通入B,平衡正向移动,反应放出更多的热;
B、平衡时,其他条件不变,当温度升高时,平衡向逆反应方向移动;
C、温度一定时,化学平衡常数是定值,结合平衡常数计算式分析;
D、通入B,平衡正向移动,反应放出更多的热;
解答:
解:A、由于A是固体,增加A的量不影响化学反应速率,故A错误;
B、平衡时,其他条件不变,当温度升高时,平衡向逆反应方向移动,θ变小,故B错误;
C、温度一定时,化学平衡常数是定值,结合平衡常数概念可知,K=
,图中曲线的斜率是C和B物质的量计算得到,不能表示化学平衡常数,故C错误;
D、通入B,平衡正向移动,反应放出更多的热,导致体系温度升高,故D正确;
故选D.
B、平衡时,其他条件不变,当温度升高时,平衡向逆反应方向移动,θ变小,故B错误;
C、温度一定时,化学平衡常数是定值,结合平衡常数概念可知,K=
| c(C)c2(D) |
| c2(B) |
D、通入B,平衡正向移动,反应放出更多的热,导致体系温度升高,故D正确;
故选D.
点评:本题考查了和平衡影响因素分析.平衡移动原理,平衡常数的理解应用,掌握基础是关键,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
向明矾溶液中滴加Ba(OH)2溶液,当SO42-沉淀完全时,铝元素的存在形式是( )
| A、部分为 Al(OH)3沉淀,部分以Al3+形式存在 |
| B、全部以[Al(OH)4]-(AlO2-)的形式存在 |
| C、全部为Al(OH)3沉淀 |
| D、部分为Al(OH)3,部分为[Al(OH)4]- (AlO2-) |
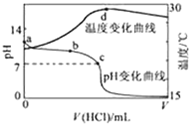 室温下,将1.000mol?L-1盐酸滴入20.00mL 1.000mol?L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )
室温下,将1.000mol?L-1盐酸滴入20.00mL 1.000mol?L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )| A、a点由水电离出的c(H+)=1.0×10-14mol/L |
| B、a、b之间可能出现:c(NH3?H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+) |
| C、c点:c(Cl-)═c(NH4+) |
| D、d点后,溶液温度略下降的主要原因是NH3?H2O电离吸热 |
常温下,取0.1 mol?L-1HY溶液与0.1 mol?L-1NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=9,则下列说法不正确的是( )
| A、c(Na+)═c(Y-)+c(HY) |
| B、c(OH-)═c(H+)+c(HY) |
| C、c(Y-)>c(Na+)>c(OH-)>c(H+) |
| D、c(Na+)+c(H+)═c(OH-)+c(Y-) |
甲、乙、丙、丁四种易溶于水的物质,分别由NH4+、Ba2+、Mg2+、H+、OH-、Cl-、HCO3-、SO42-中的不同阳离子和阴离子各一种组成.已知:①将甲溶液分别与其它三种物质的溶液混合,均有白色沉淀生成;②0.1mol/L乙溶液中c(H+)>0.1mol/L;③向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成.下列结论不正确的是( )
| A、甲溶液含有Ba2+ |
| B、乙溶液含有SO42- |
| C、丙溶液含有NH4+ |
| D、丁溶液含有HCO3- |
已知一定条件下二氧化碳气体的溶解平衡CO2(g)?CO2(aq)△H=-19.75kJ/mol,为增大CO2气体在水中的溶解度,下列方法一定可行的是( )
| A、升温增压 | B、降温减压 |
| C、升温减压 | D、降温增压 |
已知反应2I-+S2O82-═I2+2SO42-,加入淀粉溶液可观察到溶液变蓝色.反应速率可以用淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大.20℃时得到如下实验数据:
分析上述数据,下列说法正确的是( )
| 实验编号 | C(I-)/mol?L | C(S2O82-)/mol?L | t/s |
| 1 | 0.040 | 0.040 | 88.0 |
| 2 | 0.080 | 0.040 | 44.0 |
| 3 | 0.080 | 0.080 | 22.0 |
| 4 | 0.160 | 0.020 | 44.0 |
| 5 | 0.120 | 0.040 | 29.3 |
| A、该实验的目的是研究 I- 与S2O82- 的浓度对反应速率的影响 |
| B、I-的浓度越大,反应速率越快 |
| C、S2O82- 的浓度越小,反应速率越快 |
| D、5个实验中,编号3对应浓度的实验,反应速率最快 |
