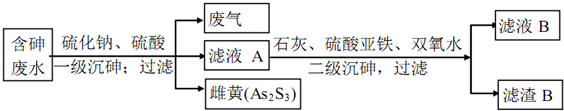
题目内容
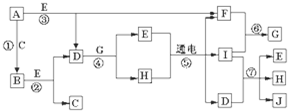
A-J是中学化学中常见的几种物质,它们之间的转化关系如图所示.已知常温下A为固体单质,B为淡黄色粉末,C、F、I为气态单质,E在常温下为液体,且E可由C、F合成,J可用作杀菌消毒剂. 回答下列问题:
(1)B的化学式: ,E的电子式 .
(2)写出反应⑦的离子方程式 .
(3)向AlCl3溶液中加入少量固体B,写出反应的化学方程式 .
(4)以Pt为电极电解滴加有少量酚酞的H饱和溶液,则在 (填“阴、阳”)极附近溶液由无色变为红色,其原因是 .

(1)B的化学式:
(2)写出反应⑦的离子方程式
(3)向AlCl3溶液中加入少量固体B,写出反应的化学方程式
(4)以Pt为电极电解滴加有少量酚酞的H饱和溶液,则在
考点:无机物的推断
专题:
分析:常温下A为固体单质,B为淡黄色粉末,则A为Na,B为Na2O2,那么C为O2,E在常温下为液体,应为H2O,则F为H2,
D为NaOH,H的水溶液在通电的情况下反应生成H2、I和NaOH,应为电解饱和食盐水的反应,则I为Cl2,可知G为HCl,
H为NaCl,Cl2和NaOH反应生成NaCl、H2O和NaClO,则J为NaClO,
(1)B为Na2O2,为离子化合物,E为H2O,为共价化合物;
(2)Cl2和NaOH反应生成NaCl、H2O和NaClO;
(3)向AlCl3溶液中加入少量过氧化钠,分别发生:2Na2O2+2H2O=4NaOH+O2↑,AlCl3+3NaOH=Al(OH)3↓+3NaCl,可写出总反应方程式;
(4)电解饱和食盐水,阳极反应为:2Cl--2e-=Cl2,阴极反应为2H++2e-=H2,从水的电离平衡移动的角度解答.
D为NaOH,H的水溶液在通电的情况下反应生成H2、I和NaOH,应为电解饱和食盐水的反应,则I为Cl2,可知G为HCl,
H为NaCl,Cl2和NaOH反应生成NaCl、H2O和NaClO,则J为NaClO,
(1)B为Na2O2,为离子化合物,E为H2O,为共价化合物;
(2)Cl2和NaOH反应生成NaCl、H2O和NaClO;
(3)向AlCl3溶液中加入少量过氧化钠,分别发生:2Na2O2+2H2O=4NaOH+O2↑,AlCl3+3NaOH=Al(OH)3↓+3NaCl,可写出总反应方程式;
(4)电解饱和食盐水,阳极反应为:2Cl--2e-=Cl2,阴极反应为2H++2e-=H2,从水的电离平衡移动的角度解答.
解答:
解:常温下A为固体单质,B为淡黄色粉末,则A为Na,B为Na2O2,那么C为O2,E在常温下为液体,应为H2O,则F为H2,
D为NaOH,H的水溶液在通电的情况下反应生成H2、I和NaOH,应为电解饱和食盐水的反应,则I为Cl2,可知G为HCl,
H为NaCl,Cl2和NaOH反应生成NaCl、H2O和NaClO,则J为NaClO,则
(1)(1)由上分析知B为Na2O2,E为H2O,电子式为 ,故答案为:Na2O2;
,故答案为:Na2O2; ;
;
(2)Cl2和NaOH反应生成NaCl、H2O和NaClO,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(3)向AlCl3溶液中加入少量过氧化钠,过氧化钠首先和水反应生成NaOH和O2,进而NaOH与AlCl3反应生成4Al(OH)3↓沉淀,反应的化学方程式为
4AlCl3+6Na2O2+6H2O=4Al(OH)3↓+12NaCl+3O2↑,故答案为:4AlCl3+6Na2O2+6H2O=4Al(OH)3↓+12NaCl+3O2↑;
(4)电解饱和食盐水,阳极反应为:2Cl--2e-=Cl2,阴极反应为2H++2e-=H2,在阴极由于H+得到电子产生H2,破坏了水的电离平衡,促进水继续电离,
导致溶液中c(OH-)>c(H+),溶液呈碱性,所以阴极附近溶液变为红色,
故答案为:阴;在阴极由于H+得到电子产生H2,破坏了水的电离平衡,促进水继续电离,导致溶液中c(OH-)>c(H+),溶液呈碱性,所以阴极附近溶液变为红色.
D为NaOH,H的水溶液在通电的情况下反应生成H2、I和NaOH,应为电解饱和食盐水的反应,则I为Cl2,可知G为HCl,
H为NaCl,Cl2和NaOH反应生成NaCl、H2O和NaClO,则J为NaClO,则
(1)(1)由上分析知B为Na2O2,E为H2O,电子式为
 ,故答案为:Na2O2;
,故答案为:Na2O2; ;
;(2)Cl2和NaOH反应生成NaCl、H2O和NaClO,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(3)向AlCl3溶液中加入少量过氧化钠,过氧化钠首先和水反应生成NaOH和O2,进而NaOH与AlCl3反应生成4Al(OH)3↓沉淀,反应的化学方程式为
4AlCl3+6Na2O2+6H2O=4Al(OH)3↓+12NaCl+3O2↑,故答案为:4AlCl3+6Na2O2+6H2O=4Al(OH)3↓+12NaCl+3O2↑;
(4)电解饱和食盐水,阳极反应为:2Cl--2e-=Cl2,阴极反应为2H++2e-=H2,在阴极由于H+得到电子产生H2,破坏了水的电离平衡,促进水继续电离,
导致溶液中c(OH-)>c(H+),溶液呈碱性,所以阴极附近溶液变为红色,
故答案为:阴;在阴极由于H+得到电子产生H2,破坏了水的电离平衡,促进水继续电离,导致溶液中c(OH-)>c(H+),溶液呈碱性,所以阴极附近溶液变为红色.
点评:本题考查无机物的推断,题目难度较大,本题易错点为(3),注意过氧化钠的量的多少,解答本题时注意题给信息.

练习册系列答案
相关题目
常温下,将熟石灰加入一定体积的水中,形成悬浊液(设pH=13),下列说法正确的是( )
| A、保持温度一定,向该浊液中加入适量的生石灰,溶液pH>13 |
| B、保持温度一定,向该浊液中加入适量的生石灰,溶液Ca2+数目减小 |
| C、向浊液中加入适量的Na2CO3或NH4Cl溶液,都会使溶液变得澄清 |
| D、将浊液加热蒸发掉一部分水,或加入pH=12的烧碱溶液,都能使浊液中固体的质量增大 |
 在盛有足量M的体积可变的密闭容器中加入N,发生反应:M (s)+2N (g)═4P (s)+Q(g)△H<0.在一定温度、压强下达到平衡,平衡时P的物质的量与起始时加入N的物质的量的转化关系如图所示.下列说法正确的是( )
在盛有足量M的体积可变的密闭容器中加入N,发生反应:M (s)+2N (g)═4P (s)+Q(g)△H<0.在一定温度、压强下达到平衡,平衡时P的物质的量与起始时加入N的物质的量的转化关系如图所示.下列说法正确的是( )| A、平衡时N的转化率为50% |
| B、当温度升高后,则图中θ>450 |
| C、若再加入N,则正、逆反应速率均逐渐增大 |
| D、若在加入N,则反应体系中气体密度减小 |
下列叙述正确的是( )
| A、足量的硫单质与64g铜反应,有2mol电子发生转移 |
| B、常温下,向AgCl悬浊液中加入少量NaCl固体后振荡,Kap(AgCl)增大 |
| C、0.1mol?L-1Na2CO3中加入少量NaOH固体振荡,c(Na+)和c(CO32-)都增大 |
| D、相同浓度的CH2COOH和CH2COONa溶液等体积混合后,则:c(CH2COO-)+c(CH2COOH)=c(Na+) |
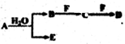 A、B、C、D、E、F为中学化学中的常见物质,且物质A由1-2种短周期元素组成,在一定条件下有如下转化关系,请外完成下列问题:
A、B、C、D、E、F为中学化学中的常见物质,且物质A由1-2种短周期元素组成,在一定条件下有如下转化关系,请外完成下列问题: 亚硝酸钠(NaNO2)易溶于水,微溶于乙醚,是常用的食品发色剂
亚硝酸钠(NaNO2)易溶于水,微溶于乙醚,是常用的食品发色剂