题目内容
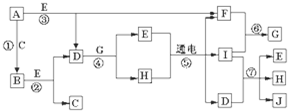
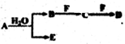 A、B、C、D、E、F为中学化学中的常见物质,且物质A由1-2种短周期元素组成,在一定条件下有如下转化关系,请外完成下列问题:
A、B、C、D、E、F为中学化学中的常见物质,且物质A由1-2种短周期元素组成,在一定条件下有如下转化关系,请外完成下列问题:(1)若常温下A为有色气体,C为直线裂分子,E具有漂白性,物质F焰色反应呈黄色,则C的电子式为
(2)若A为淡黄色固体,D为白色难溶于水的物质,且A和D的相对分子质量相等,则晶体A中微粒个数比为
(3)若A中一种元素一种的最外层电子数为内层电子数的
| 1 |
| 5 |
考点:无机物的推断
专题:推断题
分析:A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,由转化关系可知,B、E为短周期元素组成,
(1)A为有色气体,与水反应生成B与E,E具有漂白性,则A为氯气、B为HCl、E为HClO,物质F焰色反应呈黄色,含有Na元素,C为直线型分子,结合转化关系可知,F为碳酸钠、C为二氧化碳、D为碳酸氢钠;
(2)A为淡黄色固体,能与水反应,则A为过氧化钠,物质A和D的式量相等,结合转化关系,B为氢氧化钠、C为偏铝酸钠、F为铝盐、D为氧化铝、E为氧气;
(3)若物质A中一种元素原子的最外层电子数为内层电子总数的
,则该元素注意有3个电子层,最外层电子数为2,则该元素为Mg,B和D分别溶于水,所得溶液按恰当比例混合,可得一不含金属元素的盐溶液,为铵盐,A中含有氮元素,A为Mg3N2,结合转化关系,可知B为氨气、F为氧气、C为NO、D为硝酸,E为氢氧化镁.
(1)A为有色气体,与水反应生成B与E,E具有漂白性,则A为氯气、B为HCl、E为HClO,物质F焰色反应呈黄色,含有Na元素,C为直线型分子,结合转化关系可知,F为碳酸钠、C为二氧化碳、D为碳酸氢钠;
(2)A为淡黄色固体,能与水反应,则A为过氧化钠,物质A和D的式量相等,结合转化关系,B为氢氧化钠、C为偏铝酸钠、F为铝盐、D为氧化铝、E为氧气;
(3)若物质A中一种元素原子的最外层电子数为内层电子总数的
| 1 |
| 5 |
解答:
解:(1)A为有色气体,与水反应生成B与E,E具有漂白性,则A为氯气、B为HCl、E为HClO,物质F焰色反应呈黄色,含有Na元素,C为直线型分子,结合转化关系可知,F为碳酸钠、C为二氧化碳、D为碳酸氢钠,二氧化碳的电子式为: ,二氧化碳分子为直线型,正负电荷中心重合,分子为非极性分子,Cl2与H2O反应的化学方程式为,Cl2+H2O=H++Cl-+HClO,
,二氧化碳分子为直线型,正负电荷中心重合,分子为非极性分子,Cl2与H2O反应的化学方程式为,Cl2+H2O=H++Cl-+HClO,
故答案为: ;非极性;Cl2+H2O=H++Cl-+HClO;
;非极性;Cl2+H2O=H++Cl-+HClO;
(2)A为淡黄色固体,能与水反应,则A为过氧化钠,物质A和D的式量相等,结合转化关系,B为氢氧化钠、C为偏铝酸钠、F为铝盐、D为氧化铝、E为氧气.过氧化钠中钠离子与过氧根离子比例为2:1,用离子方程式表示物质F的水溶液呈酸性的原因为:Al3++3H2O?Al(OH)3+3H+,
故答案为:2:1;Al3++3H2O?Al(OH)3+3H+;
(3)若物质A中一种元素原子的最外层电子数为内层电子总数的
,则该元素原子有3个电子层,最外层电子数为2,则该元素为Mg,B和D分别溶于水,所得溶液按恰当比例混合,可得一不含金属元素的盐溶液,为铵盐,A中含有氮元素,A为Mg3N2,结合转化关系,可知B为氨气、F为氧气、C为NO、D为硝酸,E为氢氧化镁.则A与H2O反应的化学方程式为:Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑,B转化为C的化学方程式为:4NH3+5O2
4NO+6H2O,
故答案为:Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑;4NH3+5O2
4NO+6H2O.
 ,二氧化碳分子为直线型,正负电荷中心重合,分子为非极性分子,Cl2与H2O反应的化学方程式为,Cl2+H2O=H++Cl-+HClO,
,二氧化碳分子为直线型,正负电荷中心重合,分子为非极性分子,Cl2与H2O反应的化学方程式为,Cl2+H2O=H++Cl-+HClO,故答案为:
 ;非极性;Cl2+H2O=H++Cl-+HClO;
;非极性;Cl2+H2O=H++Cl-+HClO;(2)A为淡黄色固体,能与水反应,则A为过氧化钠,物质A和D的式量相等,结合转化关系,B为氢氧化钠、C为偏铝酸钠、F为铝盐、D为氧化铝、E为氧气.过氧化钠中钠离子与过氧根离子比例为2:1,用离子方程式表示物质F的水溶液呈酸性的原因为:Al3++3H2O?Al(OH)3+3H+,
故答案为:2:1;Al3++3H2O?Al(OH)3+3H+;
(3)若物质A中一种元素原子的最外层电子数为内层电子总数的
| 1 |
| 5 |
| ||
| △ |
故答案为:Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑;4NH3+5O2
| ||
| △ |
点评:本题考查无机物推断,难度中等,熟练掌握元素化合物的性质是关键,侧重考查学生对常见物质性质与特殊反应考查.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
某溶液中可能含有SO42-、CO32-、Cl-,为了检验其中是否含有SO42-,除BaCl2液外,还需要的溶液是( )
| A、H2SO4 |
| B、HCl |
| C、NaOH |
| D、NaNO3 |
下列事实不能用勒夏特列原理解释的是( )
| A、由H2、I2(g)、HI组成的平衡体系,加压(缩体积)后颜色加深 |
| B、开启啤酒瓶后,瓶中马上泛起大量泡沫 |
| C、实验室中常用排饱和食盐水的方法收集氯气 |
| D、合成氨中增加N2的物质的量浓度可提高H2的转化率 |
下列说法中正确的是( )
| A、在一定温度和压强下,各种气态物质体积大小由分子间距离决定 |
| B、相同温度时,CO2和N2O若体积相同,则它们的质量一定相同 |
| C、100g浓度为18mol/L的浓硫酸中加入等质量的水稀释浓度大于9mol/L |
| D、14 mol/L的H2SO4溶液的溶质质量分数为80%,那么7 mol/L的H2SO4溶液的溶质质量分数将大于40% |
向某密闭容器中加入0.3mol A、0.1mol C和一定量的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图1所示.图2为t2时刻后改变容器中条件,平衡体系中速率随时间变化的情况,且四个阶段都各改变一种条件,所用条件均不同.已知t3~t4阶段为使用催化剂.下列说法错误的是( )

| A、若t1=15s,生成物C在 t0~t1时间段的平均反应速率为0.004 mol?L-1?s-1 |
| B、t4~t5阶段改变的条件为减小压强,t5~t6阶段改变的条件是升高化学反应的温度 |
| C、B的起始物质的量为0.02 mol |
| D、该化学反应的表达式为:3A(g)?B(g)+2C(g) |
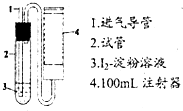 二氧化硫是造成大气污染的主要有害气体之一,某合作学习小组的同学拟测定某地大气中SO2的含量,实验步骤及装置如图:
二氧化硫是造成大气污染的主要有害气体之一,某合作学习小组的同学拟测定某地大气中SO2的含量,实验步骤及装置如图: