题目内容
 亚硝酸钠(NaNO2)易溶于水,微溶于乙醚,是常用的食品发色剂
亚硝酸钠(NaNO2)易溶于水,微溶于乙醚,是常用的食品发色剂(1)第一电离能:N
(2)亚硝酸钠在320℃会分解生成氧化钠、一氧化二氮等物质,该反应的化学方程式为
(3)亚硝酸钠是亚硝酸的钠盐.HNO2的结构如图所示,则HNO2分子中有
(4)亚硝基钻钠{Na3[Co(NO2)6]}是钴的一种配合物,易溶于水,与钾离子反应生成淡黄色的K2Na[Co(NO2)6]沉淀,可用于检验K-的存在
①基态Co3+的价层电子排布图为
②用亚硝酸钻钠检验f的离子方程式是
③金属钻的堆积方式如图所示,若一个钻原子的半径为r,则晶胞的体积V(晶胞)=
考点:元素电离能、电负性的含义及应用,元素周期律的作用,晶胞的计算
专题:化学键与晶体结构
分析:(1)因为N元素为VA族元素,N原子2p轨道排布3个电子,为半充满状态,为较稳定状态,失去电子较难,所以第一电离能:N>O;NO2-中N价电子为5,所以杂化轨道数=(5+1)÷2=3,所以N原子杂化方式为sp2,所以NO2-的空间构型为V型或角型;
(2)亚硝酸钠在3200C会分解生成氧化钠、一氧化二氮等物质,配平可得化学方程式:2NaNO2
Na2O+N2O↑+O2↑;
(3)单键为 键,双键中的一个键为 键,根据HNO2的结构简式可知HNO2分子中有3个 键;HNO3中的N的正电性高,导致N-O-H中O的电子向N偏移程度大于HNO3,更容易电离出H+,酸性更强;
(4)①Co为27号元素,Co3+的价层电子为3d6,所以基态Co3+的3d轨道有1个排布2个电子,其它4个轨道排布1个电子;
②根据亚硝基钻钠{Na3[Co(NO2)6]}与钾离子反应生成淡黄色的K2Na[Co(NO2)6]沉淀,可得离子方程式为:2K++Na++[Co(NO2)6]3-=K2Na[Co(NO2)6]↓;
③根据钴晶体堆积方式可知,其晶胞为面向立方,据此计算.
(2)亚硝酸钠在3200C会分解生成氧化钠、一氧化二氮等物质,配平可得化学方程式:2NaNO2
| ||
(3)单键为 键,双键中的一个键为 键,根据HNO2的结构简式可知HNO2分子中有3个 键;HNO3中的N的正电性高,导致N-O-H中O的电子向N偏移程度大于HNO3,更容易电离出H+,酸性更强;
(4)①Co为27号元素,Co3+的价层电子为3d6,所以基态Co3+的3d轨道有1个排布2个电子,其它4个轨道排布1个电子;
②根据亚硝基钻钠{Na3[Co(NO2)6]}与钾离子反应生成淡黄色的K2Na[Co(NO2)6]沉淀,可得离子方程式为:2K++Na++[Co(NO2)6]3-=K2Na[Co(NO2)6]↓;
③根据钴晶体堆积方式可知,其晶胞为面向立方,据此计算.
解答:
解:(1)因为N元素为VA族元素,N原子2p轨道排布3个电子,为半充满状态,为较稳定状态,失去电子较难,所以第一电离能:N>O;NO2-中N价电子为5,所以杂化轨道数=(5+1)÷2=3,所以N原子杂化方式为sp2,所以NO2-的空间构型为V型或角型;
故答案为:>、V型或角型;
(2)亚硝酸钠在3200C会分解生成氧化钠、一氧化二氮等物质,配平可得化学方程式:2NaNO2
Na2O+N2O↑+O2↑;
故答案为:2NaNO2
Na2O+N2O↑+O2↑;
(3)单键为 键,双键中的一个键为 键,根据HNO2的结构简式可知HNO2分子中有3个 键;HNO3中的N的正电性高,导致N-O-H中O的电子向N偏移程度大于HNO3,更容易电离出H+,酸性更强;
故答案为:3、HNO3中的N的正电性高,导致N-O-H中O的电子向N偏移程度大于HNO3,更容易电离出H+,酸性更强;
(4)①Co为27号元素,Co3+的价层电子为3d6,所以基态Co3+的3d轨道有1个排布2个电子,其它4个轨道排布1个电子;
故答案为: ;
;
②根据亚硝基钻钠{Na3[Co(NO2)6]}与钾离子反应生成淡黄色的K2Na[Co(NO2)6]沉淀,可得离子方程式为:2K++Na++[Co(NO2)6]3-=K2Na[Co(NO2)6]↓;
故答案为:2K++Na++[Co(NO2)6]3-=K2Na[Co(NO2)6]↓;
③根据钴晶体堆积方式可知,其晶胞为面向立方,面对角线等于4r,设晶胞的边长为a,则4r=2a,可得a=2 r,则晶胞的体积V(晶胞)=a3=(2 r)3=16
r3;故答案为:16
r3.
故答案为:>、V型或角型;
(2)亚硝酸钠在3200C会分解生成氧化钠、一氧化二氮等物质,配平可得化学方程式:2NaNO2
| ||
故答案为:2NaNO2
| ||
(3)单键为 键,双键中的一个键为 键,根据HNO2的结构简式可知HNO2分子中有3个 键;HNO3中的N的正电性高,导致N-O-H中O的电子向N偏移程度大于HNO3,更容易电离出H+,酸性更强;
故答案为:3、HNO3中的N的正电性高,导致N-O-H中O的电子向N偏移程度大于HNO3,更容易电离出H+,酸性更强;
(4)①Co为27号元素,Co3+的价层电子为3d6,所以基态Co3+的3d轨道有1个排布2个电子,其它4个轨道排布1个电子;
故答案为:
 ;
;②根据亚硝基钻钠{Na3[Co(NO2)6]}与钾离子反应生成淡黄色的K2Na[Co(NO2)6]沉淀,可得离子方程式为:2K++Na++[Co(NO2)6]3-=K2Na[Co(NO2)6]↓;
故答案为:2K++Na++[Co(NO2)6]3-=K2Na[Co(NO2)6]↓;
③根据钴晶体堆积方式可知,其晶胞为面向立方,面对角线等于4r,设晶胞的边长为a,则4r=2a,可得a=2 r,则晶胞的体积V(晶胞)=a3=(2 r)3=16
| 2 |
| 2 |
点评:本题考查电子排布图、分子空间构型、杂化类型的判断以及有关晶体的计算,但解题具有较强的方法性和规律性,学习中注意总结如何书写电子排布式,如何判断分子空间构型以及有关晶体计算等方法.

练习册系列答案
相关题目
某溶液中可能含有SO42-、CO32-、Cl-,为了检验其中是否含有SO42-,除BaCl2液外,还需要的溶液是( )
| A、H2SO4 |
| B、HCl |
| C、NaOH |
| D、NaNO3 |
将铁粉和铜粉的均匀混合物平均分成四等份,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成NO的体积和剩余金属的质量如下表(设硝酸的还原产物只有NO)下列计算结果正确的是( )
| 编号 | ① | ② | ③ | ④ |
| 稀硝酸体积/mL | 100 | 200 | 300 | 400 |
| 剩余金属/g | 18.0 | 9.6 | 0 | 0 |
| NO体积/mL | 2240 | 4480 | 6720 | V |
| A、①中溶解了5.6gFe |
| B、④中V=6720 |
| C、①的上层清液中含有Fe2+、Fe3+、Cu2+ |
| D、硝酸的浓度为4mol/L |
下列有关实验的叙述中,不合理的是( )
| A、用酸式滴定管量取25.00mL溴水 |
| B、不宜用瓷坩埚熔融氢氧化钠或碳酸钠 |
| C、测定溶液的pH时用干燥、洁净的玻璃棒蘸取溶液,滴在用蒸馏水湿润过的pH试纸上,再与标准比色卡比较 |
| D、圆底烧瓶、锥形瓶、烧杯加热时都应垫在石棉网上 |
以下现象不涉及电化学原理的是( )
| A、黄铜(铜锌合金)制作的铜锣不易产生铜绿 |
| B、纯铝制品在空气中表面逐渐失去金属光泽 |
| C、锌与稀硫酸反应时,往溶液中滴入几滴CuSO4溶液可以使反应变快 |
| D、与电源的负极相连的金属不易生锈 |
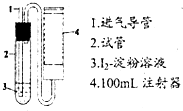 二氧化硫是造成大气污染的主要有害气体之一,某合作学习小组的同学拟测定某地大气中SO2的含量,实验步骤及装置如图:
二氧化硫是造成大气污染的主要有害气体之一,某合作学习小组的同学拟测定某地大气中SO2的含量,实验步骤及装置如图: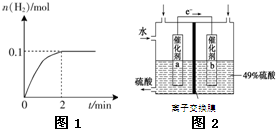 氢能被视为未来的理想清洁能源,科学家预测“氢能”将是21世纪最理想的新能源.目前分解水制氢气的工业制法之一是“硫-碘循环”,主要涉及下列反应:
氢能被视为未来的理想清洁能源,科学家预测“氢能”将是21世纪最理想的新能源.目前分解水制氢气的工业制法之一是“硫-碘循环”,主要涉及下列反应: