题目内容
9.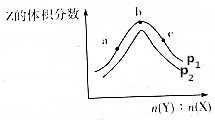 一定温度下,某密闭容器中存在反应:X(g)+2Y(g)?2Z(g),测得平衡体系中Z的体积分数与体系的压强(p)、投料比[b(Y):n(X)]关系如图所示,下列分析一定正确的是( )
一定温度下,某密闭容器中存在反应:X(g)+2Y(g)?2Z(g),测得平衡体系中Z的体积分数与体系的压强(p)、投料比[b(Y):n(X)]关系如图所示,下列分析一定正确的是( )| A. | p2>p1 | B. | Y的转化率:a<c<b | ||
| C. | b点时n(Y):n(X)=2 | D. | 该反应是一个放热反应 |
分析 根据图象,当投料比一定时,P1对应的z的体积分数要比P2大,而该反应是一个气体体积缩小的可逆反应,说明压强P1>P2;当X的量与Y的量的比值越大时,Y的转化率越大,故a点Y的转化率最大;因为起始量未知,故b点平衡时Y与X的物质的量比值不一定是2;平衡后,一定压强,随着Y的量不断增多,而Z的体积分数却在减小,说明该反应为一个放热反应,随着反应的进行,升高温度平衡逆向移动,导致Z的体积分数减小.
解答 解:A.根据图象,当投料比一定时,P1对应的z的体积分数要比P2大,而该反应是一个气体体积缩小的可逆反应,说明压强P1>P2,故A错误;
B.当X的量与Y的量的比值越大时,Y的转化率越大,故a点Y的转化率最大,故B错误;
C.因为起始量未知,故b点平衡时Y与X的物质的量比值不一定是2,故C错误;
D.平衡后,一定压强,随着Y的量不断增多,而Z的体积分数却在减小,说明该反应为一个放热反应,随着反应的进行,升高温度平衡逆向移动,导致Z的体积分数减小,故D正确.
故选:D.
点评 本题考查化学平衡图象、化学反应速率和平衡的影响因素、化学平衡常数等,难度中等,判断最低点及之后各点为平衡点是解题的关键.

练习册系列答案
相关题目
20.SO2在400~600℃下的催化氧化:2SO2+O2?2SO3,这是一个正反应放热的可逆反应.如果反应在密闭容器中进行,下述有关说法中正确的是( )
| A. | 使用催化剂是为了加快反应速率,提高生产效率 | |
| B. | 通过调控反应条件,SO2可以100%地转化为SO3 | |
| C. | SO2的浓度与SO3的浓度相等时,反应达到平衡 | |
| D. | 因为反应放热,所以升高温度会使反应速率减慢 |
17.下列相关反应的离子方程式书写正确的是( )
| A. | 已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO22ClO-+CO2+H2O=2HClO+CO32- | |
| B. | 氢氧化铁溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O | |
| C. | Na2S溶液显碱性:S2-+2H2O?H2S+2OH- | |
| D. | 用酸化的高锰酸钾溶液氧化双氧水:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O |
4.相同温度下,容积相同的甲、乙、丙3个恒容密闭容器中发生可逆反应:2SO2(g)+O2(g)?2SO3(g);△H=-197kJ•mol-1.实验测得起始、平衡时的有关数据如表:
下列叙述正确的是( )
| 容器 | 起始各物质的物质的量/mol | 达到平衡时体系能量的变化 | |||
| SO2 | O2 | SO3 | Ar | ||
| 甲 | 4 | 2 | 0 | 0 | 放出热量:Q1 |
| 乙 | 3 | 1.5 | 1 | 0 | 放出热量:Q2 |
| 丙 | 3 | 1.5 | 1 | 0.1 | 放出热量:Q3 |
| A. | Q1=Q2=Q3=394 kJ | |
| B. | 若在上述条件下反应生成2molSO3(s)的反应热为△H1,则△H1<-197 kJ•mol-1 | |
| C. | 甲、乙、丙3个容器中反应的平衡常数不相等 | |
| D. | 达到平衡时,丙容器中SO2的体积分数最大 |
14.下列实验操作与安全事故处理错误的是( )
| A. | 在气体发生装置上直接点燃甲烷气体必须先检验甲烷的纯度 | |
| B. | 制备乙酸乙酯时,将乙醇和乙酸依次加入浓硫酸中 | |
| C. | 给试管中的液体加热,不时移动试管或加人碎瓷片,以免液体暴沸伤人 | |
| D. | 实验时不慎打破温度计水银球,应立即用滴管将水银吸出,放如水封的小瓶中,残破的温度计插人装有硫粉的广口瓶中 |
14.若苯的环上三个氢原子分别被-Cl、-Br、-I取代,能生成的同分异构体数目是( )
| A. | 8种 | B. | 9种 | C. | 10种 | D. | 11种 |
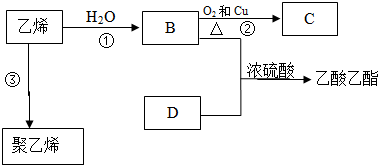
 .
. ,反应类型:加聚反应.
,反应类型:加聚反应. 
 某温度下,在2L的密闭容器中,X、Y、Z三种物质随时间变化的曲线如图所示.
某温度下,在2L的密闭容器中,X、Y、Z三种物质随时间变化的曲线如图所示. ,(2)NH3:
,(2)NH3: ,
,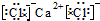 ,(4)CO2:
,(4)CO2: .
.