题目内容
17.下列相关反应的离子方程式书写正确的是( )| A. | 已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO22ClO-+CO2+H2O=2HClO+CO32- | |
| B. | 氢氧化铁溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O | |
| C. | Na2S溶液显碱性:S2-+2H2O?H2S+2OH- | |
| D. | 用酸化的高锰酸钾溶液氧化双氧水:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O |
分析 A.酸性HClO>HCO3-,则二氧化碳少量时生成碳酸氢钠;
B.铁离子具有氧化性,能够氧化碘离子;
C.硫离子的水解分步进行,主要以第一步为主,水解的离子方程式写出第一步即可;
D.酸性高锰酸钾溶液具有强氧化性,能够氧化双氧水.
解答 解:A.根据电离平衡常数大小可知三种酸性大小为:H2CO3>HClO>HCO3-,则NaClO溶液中通入少量二氧化碳反应生成次氯酸和碳酸氢钠,正确的离子方程式为:ClO-+CO2+H2O=HClO+HCO3-,故A错误;
B.铁离子能够氧化碘离子,正确的离子方程式为:2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O,故B错误;
C.Na2S溶液显碱性,是由于硫离子水解造成的,但是硫离子的水解分步进行,主要以第一步为主,正确的离子方程式为:S2-+H2O?HS-+OH-,故C错误;
D.用酸化的高锰酸钾溶液氧化双氧水,反应的离子方程式为:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O,故D正确;
故选D.
点评 本题考查了离子方程式的正误判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
7.25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A. | 0.1mol/LCH3COONa溶液与0.1mol/L HCl溶液等体积混合:c(Na+)>c(Cl-)>c(CH3COO-)>c(OH-) | |
| B. | 0.1mol/L NH4Cl溶液与0.1mol/L氨水等体积混合(pH>7):c(NH3.H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| C. | 0.1mol/L Na2CO3与0.1mol/LNaHCO3溶液等体积混合:2c(Na+)=3c(HCO3-)+3c(CO32-)+3c(H2CO3) | |
| D. | 0.1mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
8.下列说法正确的是( )
| A. | 石油是混合物,其分馏产品汽油为纯净物 | |
| B. |  的核磁共振氢谱中有4种峰 的核磁共振氢谱中有4种峰 | |
| C. | 苯甲酸的重结晶实验中,粗苯甲酸溶解后还要加点水的目的是减少过滤时苯甲酸的损失 | |
| D. | 苯中滴加浓溴水,充分震荡后溴水层褪色,是因为苯与溴水中的溴发生了加成反应 |
5.下表中对应关系正确的是( )
| A | CH3CH3+Cl2$\stackrel{光}{→}$CH3CH2Cl+HCl CH2═CH2+HCl-→CH3CH2Cl | 均为取代反应 |
| B | 甲烷的燃烧 乙烯使酸性高锰酸钾溶液褪色 | 有机物均发生了 氧化反应 |
| C | Cl2+2Br-═2Cl-+Br2 Zn+Cu2+═Zn2++Cu | 均为单质被还原的 置换反应 |
| D | 2Na2O2+2H2O═4NaOH+O2↑ Cl2+H2O?HCl+HClO | 均为水作还原剂的 氧化还原反应 |
| A. | A | B. | B | C. | C | D. | D |
12.化学工业在经济发展中的作用举足轻重,下列有关工业生产的叙述中,正确的是( )
| A. | 硫酸生产中常采用催化剂提高SO2的转化率 | |
| B. | 合成氨中采用及时分离氨气提高反应速率 | |
| C. | 电镀铜时,溶液中c(Cu2+)基本保持不变 | |
| D. | 用电解熔融氧化镁的方法制取镁 |
2.已知25℃时,Ksp(Ag2S)=6.3×10-50、Ksp(AgI)=1.5×10-16,Ag2S难溶于水和稀盐酸,可溶于硝酸,其反应方程式为Ag2S+4HNO3=2AgNO3+2NO2↑+S↓+2H2O,下列说法正确的是( )
| A. | 该反应中氧化剂与氧化产物的物质的量之比为4:1 | |
| B. | 生成3.2g S同时放出4.48LNO2 | |
| C. | AgI的悬浊液中滴加Na2S溶液可转化成黑色沉淀 | |
| D. | 若将产物NO2收集于密闭容器里再置于热水中,气体颜色变浅 |
9.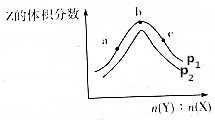 一定温度下,某密闭容器中存在反应:X(g)+2Y(g)?2Z(g),测得平衡体系中Z的体积分数与体系的压强(p)、投料比[b(Y):n(X)]关系如图所示,下列分析一定正确的是( )
一定温度下,某密闭容器中存在反应:X(g)+2Y(g)?2Z(g),测得平衡体系中Z的体积分数与体系的压强(p)、投料比[b(Y):n(X)]关系如图所示,下列分析一定正确的是( )
 一定温度下,某密闭容器中存在反应:X(g)+2Y(g)?2Z(g),测得平衡体系中Z的体积分数与体系的压强(p)、投料比[b(Y):n(X)]关系如图所示,下列分析一定正确的是( )
一定温度下,某密闭容器中存在反应:X(g)+2Y(g)?2Z(g),测得平衡体系中Z的体积分数与体系的压强(p)、投料比[b(Y):n(X)]关系如图所示,下列分析一定正确的是( )| A. | p2>p1 | B. | Y的转化率:a<c<b | ||
| C. | b点时n(Y):n(X)=2 | D. | 该反应是一个放热反应 |
2.某学习小组对影响速率的因素和氧化还原反应滴定进行探究:
探究I“影响化学反应速率的因素”,选用4mL0.01mol/LKMn04溶液与2mL0.1mol/L H2C2O4溶液在稀硫酸中进行实验,改变条件如表:
(1)实验①和②的目的是研究催化剂对化学反应速率的影响;如果研究温度对化学反应速率的影响,使用实验①和③.
(2)对比实验①和④,可以研究反应物的浓度对化学反应速率的影响,实验④中加入1mL蒸馏水的目的是确保①和④组对比实验中c(KMnO4)、c(H2C2O4)浓度不变或确保溶液总体积不变.
探究II.该小组查阅资料得知:2Mn04_+5C2042_+16H+═2Mn2++10CO2↑+8H2O,欲利用该反应测定某草酸钠(Na2C204)样品中草酸钠的质量分数.该小组称量1.34g草酸钠样品溶于稀硫酸中,然后用0.200mol/L的酸性高键酸钾溶液进行滴定(其中的杂质不跟高锰酸钾和稀硫酸反应).
(1)滴定前是否要滴加指示剂?否.(填“是”或“否”)
(2)下列操作中可能使所测Na2C204溶液的浓度数值偏低的是
A.酸式滴定管未用标准酸性高锰酸钾溶液润洗就直接注入酸性高锰酸钾溶液
B.滴定前盛放Na2C204溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取酸性高锰酸钾溶液体积时,开始仰视读数,滴定结束时俯视读数
(3)达到终点时消耗了15.00mL的高锰酸钾溶液,样品中草酸钠的质量分数为75%.
探究I“影响化学反应速率的因素”,选用4mL0.01mol/LKMn04溶液与2mL0.1mol/L H2C2O4溶液在稀硫酸中进行实验,改变条件如表:
| 组别 | 草酸的体积(mL) | 温度 | 其他物质 |
| ① | 2Ml | 20 | 无 |
| ② | 2mL | 20 | 10滴饱和MnS04溶液 |
| ③ | 2mL | 30 | 无 |
| ④ | 1mL | 20 | 1mL蒸馈水 |
(2)对比实验①和④,可以研究反应物的浓度对化学反应速率的影响,实验④中加入1mL蒸馏水的目的是确保①和④组对比实验中c(KMnO4)、c(H2C2O4)浓度不变或确保溶液总体积不变.
探究II.该小组查阅资料得知:2Mn04_+5C2042_+16H+═2Mn2++10CO2↑+8H2O,欲利用该反应测定某草酸钠(Na2C204)样品中草酸钠的质量分数.该小组称量1.34g草酸钠样品溶于稀硫酸中,然后用0.200mol/L的酸性高键酸钾溶液进行滴定(其中的杂质不跟高锰酸钾和稀硫酸反应).
(1)滴定前是否要滴加指示剂?否.(填“是”或“否”)
(2)下列操作中可能使所测Na2C204溶液的浓度数值偏低的是
A.酸式滴定管未用标准酸性高锰酸钾溶液润洗就直接注入酸性高锰酸钾溶液
B.滴定前盛放Na2C204溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取酸性高锰酸钾溶液体积时,开始仰视读数,滴定结束时俯视读数
(3)达到终点时消耗了15.00mL的高锰酸钾溶液,样品中草酸钠的质量分数为75%.
3.下列物质中,既有离子键又有共价键的是( )
| A. | MgCl2 | B. | NH4Cl | C. | CO2 | D. | H2S |