题目内容
14.下列实验操作与安全事故处理错误的是( )| A. | 在气体发生装置上直接点燃甲烷气体必须先检验甲烷的纯度 | |
| B. | 制备乙酸乙酯时,将乙醇和乙酸依次加入浓硫酸中 | |
| C. | 给试管中的液体加热,不时移动试管或加人碎瓷片,以免液体暴沸伤人 | |
| D. | 实验时不慎打破温度计水银球,应立即用滴管将水银吸出,放如水封的小瓶中,残破的温度计插人装有硫粉的广口瓶中 |
分析 A.甲烷能燃烧,不纯可发生爆炸;
B.制取混合酸时,需要类比浓硫酸的稀释进行操作,应该将浓硫酸加入到乙醇中;
C.加热时应防止局部受热,剧烈沸腾;
D.Hg有毒,与S反应生成无毒的化合物.
解答 解:A.甲烷能燃烧,不纯可发生爆炸,则先检验甲烷的纯度,再点燃,故A正确;
B.浓硫酸溶于水放出大量的热,且密度比水大,为防止酸液飞溅,应先在烧瓶中加入一定量的乙醇,然后慢慢将浓硫酸加入烧瓶,边加边振荡,不能先加入浓硫酸再加入乙醇,故B错误;
C.加热时应防止局部受热,剧烈沸腾,则给试管中的液体加热,不时移动试管或加人碎瓷片,以免液体暴沸伤人,故C正确;
D.Hg有毒,与S反应生成无毒的化合物,则实验时不慎打破温度计水银球,应立即用滴管将水银吸出,放如水封的小瓶中,残破的温度计插人装有硫粉的广口瓶中,故D正确;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、实验基本操作和实验安全为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
5.下表中对应关系正确的是( )
| A | CH3CH3+Cl2$\stackrel{光}{→}$CH3CH2Cl+HCl CH2═CH2+HCl-→CH3CH2Cl | 均为取代反应 |
| B | 甲烷的燃烧 乙烯使酸性高锰酸钾溶液褪色 | 有机物均发生了 氧化反应 |
| C | Cl2+2Br-═2Cl-+Br2 Zn+Cu2+═Zn2++Cu | 均为单质被还原的 置换反应 |
| D | 2Na2O2+2H2O═4NaOH+O2↑ Cl2+H2O?HCl+HClO | 均为水作还原剂的 氧化还原反应 |
| A. | A | B. | B | C. | C | D. | D |
2.已知25℃时,Ksp(Ag2S)=6.3×10-50、Ksp(AgI)=1.5×10-16,Ag2S难溶于水和稀盐酸,可溶于硝酸,其反应方程式为Ag2S+4HNO3=2AgNO3+2NO2↑+S↓+2H2O,下列说法正确的是( )
| A. | 该反应中氧化剂与氧化产物的物质的量之比为4:1 | |
| B. | 生成3.2g S同时放出4.48LNO2 | |
| C. | AgI的悬浊液中滴加Na2S溶液可转化成黑色沉淀 | |
| D. | 若将产物NO2收集于密闭容器里再置于热水中,气体颜色变浅 |
9.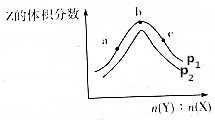 一定温度下,某密闭容器中存在反应:X(g)+2Y(g)?2Z(g),测得平衡体系中Z的体积分数与体系的压强(p)、投料比[b(Y):n(X)]关系如图所示,下列分析一定正确的是( )
一定温度下,某密闭容器中存在反应:X(g)+2Y(g)?2Z(g),测得平衡体系中Z的体积分数与体系的压强(p)、投料比[b(Y):n(X)]关系如图所示,下列分析一定正确的是( )
 一定温度下,某密闭容器中存在反应:X(g)+2Y(g)?2Z(g),测得平衡体系中Z的体积分数与体系的压强(p)、投料比[b(Y):n(X)]关系如图所示,下列分析一定正确的是( )
一定温度下,某密闭容器中存在反应:X(g)+2Y(g)?2Z(g),测得平衡体系中Z的体积分数与体系的压强(p)、投料比[b(Y):n(X)]关系如图所示,下列分析一定正确的是( )| A. | p2>p1 | B. | Y的转化率:a<c<b | ||
| C. | b点时n(Y):n(X)=2 | D. | 该反应是一个放热反应 |
19.下列叙述中正确的是( )
| A. | 只有非金属原子间才能形成共价键 | |
| B. | 有化学键断裂的变化属于化学变化 | |
| C. | 由共价键形成的物质-定是共价化合物分子 | |
| D. | 离子化合物中可能含有共价键,而共价化合物中一定不含离子键 |
2.某学习小组对影响速率的因素和氧化还原反应滴定进行探究:
探究I“影响化学反应速率的因素”,选用4mL0.01mol/LKMn04溶液与2mL0.1mol/L H2C2O4溶液在稀硫酸中进行实验,改变条件如表:
(1)实验①和②的目的是研究催化剂对化学反应速率的影响;如果研究温度对化学反应速率的影响,使用实验①和③.
(2)对比实验①和④,可以研究反应物的浓度对化学反应速率的影响,实验④中加入1mL蒸馏水的目的是确保①和④组对比实验中c(KMnO4)、c(H2C2O4)浓度不变或确保溶液总体积不变.
探究II.该小组查阅资料得知:2Mn04_+5C2042_+16H+═2Mn2++10CO2↑+8H2O,欲利用该反应测定某草酸钠(Na2C204)样品中草酸钠的质量分数.该小组称量1.34g草酸钠样品溶于稀硫酸中,然后用0.200mol/L的酸性高键酸钾溶液进行滴定(其中的杂质不跟高锰酸钾和稀硫酸反应).
(1)滴定前是否要滴加指示剂?否.(填“是”或“否”)
(2)下列操作中可能使所测Na2C204溶液的浓度数值偏低的是
A.酸式滴定管未用标准酸性高锰酸钾溶液润洗就直接注入酸性高锰酸钾溶液
B.滴定前盛放Na2C204溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取酸性高锰酸钾溶液体积时,开始仰视读数,滴定结束时俯视读数
(3)达到终点时消耗了15.00mL的高锰酸钾溶液,样品中草酸钠的质量分数为75%.
探究I“影响化学反应速率的因素”,选用4mL0.01mol/LKMn04溶液与2mL0.1mol/L H2C2O4溶液在稀硫酸中进行实验,改变条件如表:
| 组别 | 草酸的体积(mL) | 温度 | 其他物质 |
| ① | 2Ml | 20 | 无 |
| ② | 2mL | 20 | 10滴饱和MnS04溶液 |
| ③ | 2mL | 30 | 无 |
| ④ | 1mL | 20 | 1mL蒸馈水 |
(2)对比实验①和④,可以研究反应物的浓度对化学反应速率的影响,实验④中加入1mL蒸馏水的目的是确保①和④组对比实验中c(KMnO4)、c(H2C2O4)浓度不变或确保溶液总体积不变.
探究II.该小组查阅资料得知:2Mn04_+5C2042_+16H+═2Mn2++10CO2↑+8H2O,欲利用该反应测定某草酸钠(Na2C204)样品中草酸钠的质量分数.该小组称量1.34g草酸钠样品溶于稀硫酸中,然后用0.200mol/L的酸性高键酸钾溶液进行滴定(其中的杂质不跟高锰酸钾和稀硫酸反应).
(1)滴定前是否要滴加指示剂?否.(填“是”或“否”)
(2)下列操作中可能使所测Na2C204溶液的浓度数值偏低的是
A.酸式滴定管未用标准酸性高锰酸钾溶液润洗就直接注入酸性高锰酸钾溶液
B.滴定前盛放Na2C204溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取酸性高锰酸钾溶液体积时,开始仰视读数,滴定结束时俯视读数
(3)达到终点时消耗了15.00mL的高锰酸钾溶液,样品中草酸钠的质量分数为75%.
19.下列有关实验操作、现象和解释或结论都正确的是( )
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 向某溶液中加入足量稀盐酸无现象,再滴加BaCl2溶液 | 有白色沉淀生成 | 原溶液中有SO42- |
| B | Agl沉淀中滴入稀KCl溶液 | 有白色沉淀生成 | AgCl比AgI更难溶 |
| C | 向CH3CH2X中加入少量AgNO3溶液,加热 | 有浅黄色沉淀生成 | CH3CH2X中含有Br- |
| D | C2H5OH与浓硫酸170℃共热,制得的气体通入酸性KMnO4溶液 | KMnO4溶液褪色 | 使KMnO4溶液褪色的是乙烯 |
| A. | A | B. | B | C. | C | D. | D |
20.有关化学用语正确的是( )
| A. | 乙酸的实验式C2H402 | B. | 聚丙烯的结构简式: | ||
| C. | 羟基的电子式 | D. | 乙酸分子的球棍模型 |

 ,G中的化学键有离子键、共价键,D跟G反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2.
,G中的化学键有离子键、共价键,D跟G反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2.