题目内容
15.(1)P4S10能发生水解反应:P4S10+16H2O═4H3PO4+10H2S.①P4S10中共价键类型为极性键.
②H2O的沸点比H2S的高,主要原因是水分子间可形成氢键;与H2O键合方式相同且与其互为等电子体的阳离子为H2F+,阴离子为NH2-.
(2)磷化镓是一种半导体,晶胞结构如图所示,晶胞边长a=0.545nm,则磷化镓的密度为$\frac{100.7×4}{{N}_{A}×(5.45{×10}^{-10})^{3}}$g•cm-3(设NA表示阿伏伽德罗常数的值,不必计算出结果).
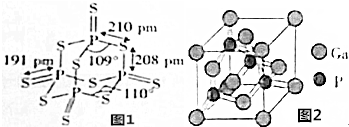
分析 (1)①由图1P4S10的结构式可知,含有的共价键为P-S、P=S,都是极性共价键;
②水分子间可形成氢键,等电子体是指具有原子总数相同、价电子总数相同的微粒;
(2)一个晶胞中含有Ca的个数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,含有P的个数为4,一个晶胞的质量为m=$\frac{100.7×4}{{N}_{A}}$g,晶胞的体积V=(5.45×10-10cm)3,带入$ρ=\frac{m}{V}$计算.
解答 解:(1)①由图1P4S10的结构式可知,含有的共价键为P-S、P=S,都是极性共价键,
故答案为:极性键;
②水分子间可形成氢键,使得H2O的沸点比H2S的高,H2O分子中有3个原子、10个价电子,互为等电子体的阳离子为H2F+,互为等电子体的阴离子为NH2-,
故答案为:水分子间可形成氢键;H2F+;NH2-;
(2)一个晶胞中含有Ca的个数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,含有P的个数为4,一个晶胞的质量为m=$\frac{100.7×4}{{N}_{A}}$g,晶胞的体积V=(5.45×10-10cm)3,$ρ=\frac{m}{V}$=$\frac{\frac{100.7×4}{{N}_{A}}g}{(5.45×1{0}^{-10}cm){\;}^{3}}$=$\frac{100.7×4}{{N}_{A}×(5.45{×10}^{-10})^{3}}$g•cm-3,
故答案为:$\frac{100.7×4}{{N}_{A}×(5.45{×10}^{-10})^{3}}$.
点评 本题考查共价键的类型、氢键、等电子体、晶胞的计算等知识,综合性较强,难点为等电子体和晶胞的计算,题目难度中等.

| A. | 由非金属元素组成的化合物中一定不含离子键 | |
| B. | 离子化合物一定含有金属元素 | |
| C. | 分子中一定含有共价键 | |
| D. | 某种离子化合物可以同时含有离子键、极性共价键 |
| A. | 显蓝色、无现象 | B. | 显蓝色、红色沉淀 | ||
| C. | 无现象、变黑色 | D. | 无现象、红色沉淀 |
| A. | 石油分馏是利用加热的方法将石油分成不同沸点产物的方法 | |
| B. | 石油分馏得到的分馏产物仍是一些混合物 | |
| C. | 石油分馏可以得到石油气、汽油、煤气、乙烯和丙烯等产品 | |
| D. | 石油分馏过程是加热条件下发生的化学变化 |
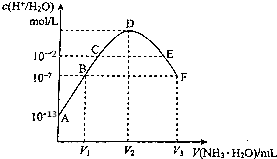
| A. | C点所示溶液中:pH=14-a | |
| B. | D点所示溶液中:c(H+)-c(OH-)=2c(NH3•H2O) | |
| C. | E点所示溶液中:c(NH4+)>c(SO42-)>c(OH-)>c(H+) | |
| D. | F点所示溶液中:c(NH4+)=2c(SO42-) |
| A. | pH=7的NaHSO3与Na2SO3混合溶液中:c(Na+)=c(HSO3-)+c(SO32-) | |
| B. | 等物质的量浓度的下列溶液中:①NH4Al(SO4)2 ②NH4Cl ③CH3COONH4 ④NH3•H2O,c(NH4+)由大到小的顺序是①>②>③>④ | |
| C. | 0.1 mol•L-1的醋酸的pH=a,0.01 mol•L-1的醋酸的pH=b,则a+1=b | |
| D. | 0.1 mol•L-1的醋酸钠溶液20 mL与0.1 mol•L-1的盐酸10 mL混合后溶液显酸性,则有:c(CH3COOH)>c(H+)>c(Cl-)>c(CH3COO-) |
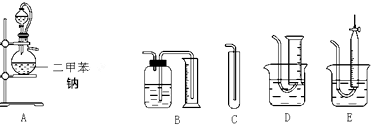
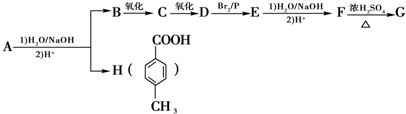
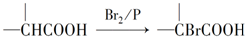
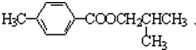 .
.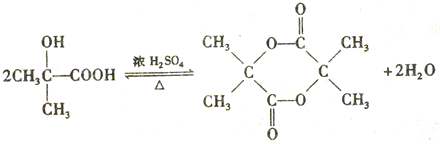 .
.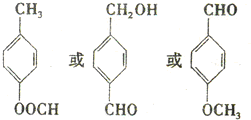 .
. )结构.
)结构.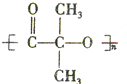 ,形成该聚合物的反应类型为:缩聚反应.
,形成该聚合物的反应类型为:缩聚反应.