题目内容
20.常温下,向20mL的某稀H2SO4溶液中滴入0.1mol/L氨水,溶液中水电离出氢离子浓度随滴入氨水体积变化如图所示.下列分析正确的是( )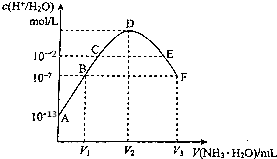
| A. | C点所示溶液中:pH=14-a | |
| B. | D点所示溶液中:c(H+)-c(OH-)=2c(NH3•H2O) | |
| C. | E点所示溶液中:c(NH4+)>c(SO42-)>c(OH-)>c(H+) | |
| D. | F点所示溶液中:c(NH4+)=2c(SO42-) |
分析 A.根据C点的溶液中水电离出的氢离子浓度结合水的离子积来进行计算;
B.根据质子守恒分析解答;
C.E溶液显示酸性,根据盐的水解原理来比较离子浓度;
D.根据电荷守恒结合溶液呈中性分析解答.
解答 解:A.C点的溶液中水电离出的氢离子浓度是10-2,此时的溶液显示酸性是由铵根离子水解所致,溶液中氢离子由水电离,则pH=2,故A错误;
B.C点所示溶液是硫酸铵溶液,质子守恒得:c(H+)-c(OH-)═c(NH3.H2O),故B错误;
C.E溶液显示酸性,硫酸铵和氨水的混合物,得到的溶液中铵根离子的水解程度较强,所以c(NH4+)>c(SO42-)>c(H+)>c(OH-),故C错误;
D.根据电荷守恒:c(H+)+c(NH4+)═2c(SO42-)+c(OH-),而溶液呈中性c(OH-)═c(H+),所以c(NH4+)═2c(SO42-),故D正确.
故选D.
点评 本题考查学生酸碱混合的酸碱性的判断以及盐的水解原理的应用知识,属于综合知识的考查,难度中等,侧重于考查学生 的分析能力和计算能力.

练习册系列答案
相关题目
11.四种短周期元素X、Y、Z、W的原子序数依次增大,依据表中信息判断,下列说法正确的是( )
| 元素 | X | Y | Z | W |
| 相关信息 | 元素周期表中核电荷数最小的元素 | 大气中含量最多的元素,其某些氧化物为大气中常见的污染物 | 地壳中含量最多的金属元素 | 原子最外层电子数是电子层数的二倍 |
| A. | X、Y、W三种元素不可能形成离子化合物 | |
| B. | Z的简单离子半径比Y的简单离子半径大 | |
| C. | 工业上常常通过电解Z的熔融氯化物的方法来获得Z的单质 | |
| D. | W的单质在氧气中燃烧火焰呈蓝紫色 |
8.化学与生活是紧密相连的,下列说法正确的是( )
| A. | 食用油脂饱和程度越大,熔点越高 | |
| B. | 海水淡化能解决淡水供应危机,向海水中加净水剂明矾可以使海水淡化 | |
| C. | 铁在潮湿的空气中放置,易发生化学腐蚀而生锈 | |
| D. | 用含有橙色的酸性重铬酸钾的仪器检验酒后驾车,利用了乙醇的氧化性 |
4.含氮的化合物广泛存在于自然界,是一类非常重要的化合物.回答下列有关问题:
(1)在一定条件下:2N2(g)+6H2O(g)═4NH3(g)+3O2(g).已知该反应的相关的化学键键能数据如下:
则该反应的△H=+1268kJ/mol.
(2)电厂烟气脱氮的主要反应I:4NH3(g)+6NO(g)?5N2(g)+6H2O(g)△H<0,副反应II:2NH3(g)+8NO(g)?5N2O(g)+3H2O(g)△H>0.
①反应I的化学平衡常数的表达式为$\frac{{C}^{6}({H}_{2}O){C}^{5}({N}_{2})}{{C}^{6}(NO){C}^{4}(N{H}_{3})}$.
②对于在2L密闭容器中进行的反应I,在一定条件下n(NH3)和n(N2)随时间变化的关系如图1所示:

用NH3表示从开始到t1时刻的化学反应速率为$\frac{a-b}{2{t}_{1}}$(用a、b、t表示)mol/(L•min),图中表示已达平衡的点为CD.
③电厂烟气脱氮的平衡体系的混合气体中N2和N2O含量与温度的关系如图2所示,在温度420~550K时,平衡混合气体中N2O含量随温度的变化规律是随温度升高,N2的含量降低,造成这种变化规律的原因是主反应为放热反应,升温使主反应的平衡左移或者副反应为吸热反应,升温使副反应的平衡右移,降低了NH3和NO浓度,使主反应的平衡左移.
(3)电化学降解法可治理水中硝酸盐的污染.电化学降解NO3-的原理如图3所示,电源正极为a(填“a”或“b”),阴极电极反应式为2NO3-+10e-+12H+=6H2O+N2↑.
(1)在一定条件下:2N2(g)+6H2O(g)═4NH3(g)+3O2(g).已知该反应的相关的化学键键能数据如下:
| 化学键 | N≡N | H-O | N-H | O=O |
| E/(kJ/mol) | 946 | 463 | 391 | 496 |
(2)电厂烟气脱氮的主要反应I:4NH3(g)+6NO(g)?5N2(g)+6H2O(g)△H<0,副反应II:2NH3(g)+8NO(g)?5N2O(g)+3H2O(g)△H>0.
①反应I的化学平衡常数的表达式为$\frac{{C}^{6}({H}_{2}O){C}^{5}({N}_{2})}{{C}^{6}(NO){C}^{4}(N{H}_{3})}$.
②对于在2L密闭容器中进行的反应I,在一定条件下n(NH3)和n(N2)随时间变化的关系如图1所示:

用NH3表示从开始到t1时刻的化学反应速率为$\frac{a-b}{2{t}_{1}}$(用a、b、t表示)mol/(L•min),图中表示已达平衡的点为CD.
③电厂烟气脱氮的平衡体系的混合气体中N2和N2O含量与温度的关系如图2所示,在温度420~550K时,平衡混合气体中N2O含量随温度的变化规律是随温度升高,N2的含量降低,造成这种变化规律的原因是主反应为放热反应,升温使主反应的平衡左移或者副反应为吸热反应,升温使副反应的平衡右移,降低了NH3和NO浓度,使主反应的平衡左移.
(3)电化学降解法可治理水中硝酸盐的污染.电化学降解NO3-的原理如图3所示,电源正极为a(填“a”或“b”),阴极电极反应式为2NO3-+10e-+12H+=6H2O+N2↑.
1.W、X、Y、Z是原子序数依次增大的短周期主族元索.W、X均可与氧元素形成原子个数比分别为1:1、2:1的两种化合物,其中原子个数比为1:1的两种化合物Q、P均有较强的氧化性,同周期元素形成的单核离子中,Y的离子半径最小,Z可形成强酸,下列说法错误的是( )
| A. | Z的氢化物稳定性可能较差 | B. | Q、P中均含有非极性键 | ||
| C. | 对应单质失去电子的能力:W>Y>Z | D. | 单质熔点:Y>X>W |

 .
. .
. 乙$\stackrel{NaHCO_{3}}{→}$丙(C13H9O2Na)
乙$\stackrel{NaHCO_{3}}{→}$丙(C13H9O2Na) .
.