题目内容
17.常温下,下列各溶液的叙述中正确的是( )| A. | pH=7的NaHSO3与Na2SO3混合溶液中:c(Na+)=c(HSO3-)+c(SO32-) | |
| B. | 等物质的量浓度的下列溶液中:①NH4Al(SO4)2 ②NH4Cl ③CH3COONH4 ④NH3•H2O,c(NH4+)由大到小的顺序是①>②>③>④ | |
| C. | 0.1 mol•L-1的醋酸的pH=a,0.01 mol•L-1的醋酸的pH=b,则a+1=b | |
| D. | 0.1 mol•L-1的醋酸钠溶液20 mL与0.1 mol•L-1的盐酸10 mL混合后溶液显酸性,则有:c(CH3COOH)>c(H+)>c(Cl-)>c(CH3COO-) |
分析 A.根据溶液中的电荷守恒分析;
B.①铝离子水解抑制铵根离子的水解;②铵根离子水解;③弱碱电离,且电离的程度很弱;④醋酸根离子水解促进铵根离子水解;
C.醋酸的浓度越大,电离程度越小;
D.将0.1mol/L的醋酸钠溶液20mL与0.1mol/L盐酸10mL混合后,反应后NaAc和HAc的物质的量相等,溶液显酸性,说明HAc电离程度大于Ac-水解程度.
解答 解:A.pH=7的NaHSO3与Na2SO3混合溶液中电荷守恒为:c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-),由于溶液显中性,则c(H+)=c(OH-),所以c(Na+)=c(HSO3-)+2c(SO32-),故A错误;
B.同浓度的下列溶液:①NH4Al(SO4)2②NH4Cl③CH3COONH4,④NH3•H2O,因①中铝离子水解抑制铵根离子的水解;②中铵根离子水解;③醋酸根离子水解促进铵根离子水解;④弱碱电离,且电离的程度很弱,则c(NH4+)由大到小的顺序是:①>②>③>④,故B正确;
C.醋酸的浓度越大,电离程度越小,0.1 mol•L-1的醋酸的pH=a,0.01 mol•L-1的醋酸的pH=b,后者的电离程度大,所以a+1>b,故C错误;
D.将0.1mol/L的醋酸钠溶液20mL与0.1mol/L盐酸10mL混合后,反应后NaAc和HAc的物质的量相等,溶液显酸性,说明HAc电离程度大于Ac-水解程度,则c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+),故D错误.
故选B正确.
点评 本题考查离子浓度大小的比较,难度较大,熟悉酸的强弱与盐的水解的关系,电荷守恒、水解与电离的程度及相互影响是解答本题的关键.

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案
相关题目
5.下列物质中,属于混合物的是( )
| A. | 酒精 | B. | 碘酒 | C. | 水银 | D. | 黄金 |
12.下列物质属于纯净物的是( )
| A. | 氯乙烯 | B. | 汽油 | C. | 牛奶 | D. | 聚乙烯 |
9.由A、B两种气态烃组成的混合气体,对H2 的相对密度为17,常温常压下,取这两种混合气体10ml与80ml氧气(过量)混合,当完全燃烧后恢复到原状态时,测得气体的体积为70ml,则两种气态烃的可能组成为( )
| A. | CH4和C2H4 | B. | C2H4和C3H4 | C. | C2H4和C2H6 | D. | C3H6和C2H4 |
6.由CH3-CH2Cl为原料制取HOCH2-CH2OH,最好选取的反应类型是( )
| A. | 消去、加成、取代 | B. | 加成、取代、水解 | C. | 取代、加成、消去 | D. | 加成、取代、消去 |
7.实验室从含溴化钠的废液中提取溴单质,下列说法中能达到实验目的是( )
| A. | 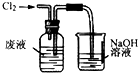 用装置甲氧化废液中的溴化钠 | B. | 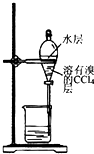 用装置乙分离CCl4层和水层 | ||
| C. |  用装置丙分离CCl4和液溴 | D. | 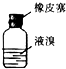 用仪器丁长期贮存液溴 |
 .
. .
.