题目内容
16.设NA表示阿伏加德罗常数的数值,下列说法正确的是( )| A. | 标准状况下,铝跟氢氧化钠溶液反应生成1mol氢气时,转移的电子数为2NA | |
| B. | 7 g CnH2n中含有的氢原子数目为NA | |
| C. | 任何气体单质在标况下体积若为22.4L,则含有2NA个原子 | |
| D. | 1mol Na2O2与水反应转移的电子数约为1.204×1024个 |
分析 A.依据2H+~H2~2e-解答;
B.CnH2n最简式为CH2,1个CH2含有2个H;
C.稀有气体为单原子分子;
D.过氧化钠与水反应为歧化反应,过氧化钠即使氧化剂又是还原剂.
解答 解:A.依据2H+~H2~2e-可知,铝跟氢氧化钠溶液反应生成1mol氢气,转移2mol电子,个数为2NA,故A正确;
B.7 g CnH2n含有CH2物质的量为$\frac{7g}{14g/mol}$=0.5mol,含有H数目为0.5mol×2×NA=NA,故B正确;
C.稀有气体为单原子分子,1mol气体中含有NA个原子,故C错误;
D.过氧化钠与水反应为歧化反应,过氧化钠即使氧化剂又是还原剂,1mol过氧化钠参加反应,转移1mol电子,个数为:6.02×1023个,故D错误;
故选:AB.
点评 本题考查阿伏加德罗常数的有关计算和判断,熟练掌握以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确稀有气体为单原子分子的结构特点是解题关键,题目难度不大.

练习册系列答案
相关题目
6.下列陈述I、II均正确并且有因果关系的是( )
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | Fe2O3是红棕色粉末 | Fe2O3常用作红色涂料 |
| B | SiO2是两性氧化物 | SiO2可和HF反应 |
| C | Al2O3难溶于水 | Al2O3可用作耐火材料 |
| D | SO2有氧化性 | SO2可使溴水褪色 |
| A. | A | B. | B | C. | C | D. | D |
7.CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示.下列说法错误的是( )

| A. | 相对于途径①,途径②更好地体现了绿色化学思想 | |
| B. | Y可以是葡萄糖 | |
| C. | CuSO4在1100℃分解所得混合气体X可能是SO2和SO3 | |
| D. | CuSO4可用于配制农药 |
4.将饱和FeCl3溶液滴入沸水并煮沸一段时间,可得到红褐色液体.下列有关说法错误的是( )
| A. | 光束通过该液体时形成光亮的“通路” | |
| B. | 插入石墨电极通直流电后,有一极附近液体颜色加深 | |
| C. | 向该液体中加入硝酸银溶液,无沉淀产生 | |
| D. | 将该液体加热、蒸干、灼烧后,有黑色固体生成 |
11.理论上,不能设计为原电池的化学反应是( )
| A. | 2H2(g)+O2(g)$\frac{\underline{\;点燃\;}}{\;}$2H2O(l)△H<0 | B. | 2FeCl3(aq)+Fe(s)═3FeCl2(aq)△H<0 | ||
| C. | CH4(g)+2O2(g)$\frac{\underline{\;点燃\;}}{\;}$CO2(g)+2H2O(l)△H<0 | D. | HNO3(aq)+NaOH(aq)═NaNO3(aq)+H2O(l)△H<0 |
8.蒸干下列溶液能得到对应固态物质的是( )
| A. | 次氯酸钠溶液:次氯酸钠 | B. | 亚硫酸钠溶液:亚硫酸钠 | ||
| C. | 氯化铜溶液:氯化铜 | D. | 硫酸铝溶液:硫酸铝 |
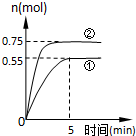 碳循环的途径之一是:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)+49.0kJ,在容积为2L的密闭容器中充入1mol CO2和3mol H2,在两种不同的实验条件下进行反应,测得CH3OH(g)的物质的量随时间变化情况如图所示:
碳循环的途径之一是:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)+49.0kJ,在容积为2L的密闭容器中充入1mol CO2和3mol H2,在两种不同的实验条件下进行反应,测得CH3OH(g)的物质的量随时间变化情况如图所示: