题目内容
12.(1)某温度时,水的离子积Kw=1×10-13,则该温度>25℃(填“>”、“<”或“=”).在此温度下,某溶液中由水电离出来的H+浓度为1×10-10 mol•L-1,则该溶液的pH可能为3或10;
(2)若温度为25℃时,体积为Va、pH=a的H2SO4与体积为Vb、pH=b的NaOH混合,恰好中和,此溶液中各种离子的浓度由大到小的排列顺序是$\frac{1}{2}$c(Na+)=c(SO42-)>c(H+)=c(OH-).
分析 (1)水的电离是吸热反应,升高温度促进水电离,则溶液的离子积常数增大,通过比较t℃)时和25℃时Kww的值判断;溶液中由水电离出来的H+浓度为1×10-10 mol•L-1,可以是酸溶液,还可以是碱溶液;
(2)25℃时,体积为Va、pH=a的H2SO4与体积为Vb、pH=b的NaOH混合,恰好中和,此溶液是硫酸钠的水溶液,据此回答.
解答 解:(1)水的电离是吸热反应,升高温度促进水电离,氢离子和氢氧根离子浓度增大,则水的离子积常数增大,25℃时纯水中c(H+)=c(OH-)=10-7 mol/L,Kw=c(H+)•c(OH-)=10-14 ,某温度(T℃)时,水的离子积常数Kw=1×10-13>10-14,则该温度大于25℃,溶液中由水电离出来的H+浓度为1×10-10 mol•L-1,可以是酸溶液,还可以是碱溶液,所以pH为3或10;
故答案为:>;3或10;
(2)25℃时,体积为Va、pH=a的H2SO4与体积为Vb、pH=b的NaOH混合,恰好中和,此溶液是硫酸钠的水溶液,显示中性,此时$\frac{1}{2}$c(Na+)=c(SO42-)>c(H+)=c(OH-),故答案为:$\frac{1}{2}$c(Na+)=c(SO42-)>c(H+)=c(OH-).
点评 本题考查了水的电离平衡、水的离子积常数的影响因素以及计算、离子浓度大小比较等知识,注意知识的归纳和梳理是关键,难度中等.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目
2.已知R是短周期元素,存在以下反应:RO3-+6I-+6H+═Rn-+3I2+3H2O.下列叙述正确的是( )
| A. | R是ⅤA族元素 | B. | n=2 | ||
| C. | R 是最外层有7个电子,只能是氯 | D. | Rn-还原性大于 I- |
3.设NA是阿伏加德罗常数的数值,下列说法不正确的是( )
| A. | 46gNO2和N2O4混合气体中含有原子总数为3NA | |
| B. | 1molCl2与足量的铁反应,转移的电子数为2NA | |
| C. | 常温常压下,Na2O2与足量H2O反应,共生成0.2molO2,转移电子的数目为0.2NA | |
| D. | 1 mol Na 与足量O2 反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
20.下列有机化合物命名正确的是( )
①1-甲基丙烷
②3,4-二甲基戊烷
③2-乙基丁烷
④3-乙基-2-甲基戊烷.
①1-甲基丙烷
②3,4-二甲基戊烷
③2-乙基丁烷
④3-乙基-2-甲基戊烷.
| A. | 只有②③ | B. | 只有③④ | C. | 都正确 | D. | 都错误 |
17.设NA为阿伏加德罗常数的值,下列说法正确的组合是( )
a 12g 金刚石中含有的碳碳键的数目为2NA
b 1mol 明矾与水完全反应转化为氢氧化铝胶体后,其中胶体粒子的数目为NA
c 1mol Na2O2与水反应转移的电子数为NA
d 常温下,1mol•L-1的NH4NO3溶液中含有氮原子的数目为2NA
e 常温下,30g SiO2晶体中含有Si-O键的数目为NA
f 17g H2O2中含有的电子数为9NA
g 将2mol SO2与1mol O2混合,发生反应转移的电子总数一定是4NA
h 常温下,100mL 1mol•L-1 AlCl3溶液中阳离子总数大于0.1NA.
a 12g 金刚石中含有的碳碳键的数目为2NA
b 1mol 明矾与水完全反应转化为氢氧化铝胶体后,其中胶体粒子的数目为NA
c 1mol Na2O2与水反应转移的电子数为NA
d 常温下,1mol•L-1的NH4NO3溶液中含有氮原子的数目为2NA
e 常温下,30g SiO2晶体中含有Si-O键的数目为NA
f 17g H2O2中含有的电子数为9NA
g 将2mol SO2与1mol O2混合,发生反应转移的电子总数一定是4NA
h 常温下,100mL 1mol•L-1 AlCl3溶液中阳离子总数大于0.1NA.
| A. | a c f h | B. | a c e g | C. | a c e f h | D. | b d e h |
4.某实验小组用工业上废渣(主要成分Cu2S和Fe2O3)制取纯铜和绿矾(FeSO4•7H2O)产品,设计流程如图:
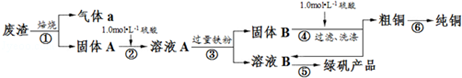
(1)在实验室中,欲用98%的浓硫酸(密度为1.84g•mL-1)配制500mL1.0mol•L-1的硫酸,需要的仪器除量筒、烧杯、玻璃棒外,还有胶头滴管、500mL容量瓶.
(2)该小组同学设计如图装置模拟废渣在过量氧气中焙烧,并验证废渣中含硫元素.

①装置A中反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑;为控制反应不过于激烈并产生平稳气流,采取的操作及现象是打开分液漏斗上口活塞,控制分液漏斗旋塞,使水匀速逐滴滴下;B处应连接盛有碱石灰的干燥管(或U形管)或浓硫酸的洗气瓶(填写试剂及仪器名称).
②E装置中加入品红溶液的目的是检验气体a中的SO2;当F装置中出现白色沉淀时,反应离子方程式为2SO2+O2+2H2O+2Ba2+=2BaSO4↓+4H+.
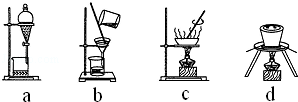
(3)下列操作中,不属于步骤⑤中进行的操作的是ad(填下列各项中序号).
(4)为测定产品中绿矾的质量分数,称取30.000g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol•L-1酸性KMnO4溶液进行滴定,反应为:10FeSO4+8H2SO4+2KMnO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O.实验所得数据如下表所示:
①第1组实验数据出现异常,造成这种异常的原因可能是ad(填代号).
a.酸式滴定管用蒸馏水洗净后未用标准液润洗 b.锥形瓶洗净后未干燥
c.滴定终点时俯视读数 d.滴定终点时仰视读数
②根据表中数据,计算所得产品中绿矾的质量分数为92.7%.

(1)在实验室中,欲用98%的浓硫酸(密度为1.84g•mL-1)配制500mL1.0mol•L-1的硫酸,需要的仪器除量筒、烧杯、玻璃棒外,还有胶头滴管、500mL容量瓶.
(2)该小组同学设计如图装置模拟废渣在过量氧气中焙烧,并验证废渣中含硫元素.

①装置A中反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑;为控制反应不过于激烈并产生平稳气流,采取的操作及现象是打开分液漏斗上口活塞,控制分液漏斗旋塞,使水匀速逐滴滴下;B处应连接盛有碱石灰的干燥管(或U形管)或浓硫酸的洗气瓶(填写试剂及仪器名称).
②E装置中加入品红溶液的目的是检验气体a中的SO2;当F装置中出现白色沉淀时,反应离子方程式为2SO2+O2+2H2O+2Ba2+=2BaSO4↓+4H+.
(3)下列操作中,不属于步骤⑤中进行的操作的是ad(填下列各项中序号).

(4)为测定产品中绿矾的质量分数,称取30.000g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol•L-1酸性KMnO4溶液进行滴定,反应为:10FeSO4+8H2SO4+2KMnO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O.实验所得数据如下表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.90 | 20.02 | 19.98 | 20.00 |
a.酸式滴定管用蒸馏水洗净后未用标准液润洗 b.锥形瓶洗净后未干燥
c.滴定终点时俯视读数 d.滴定终点时仰视读数
②根据表中数据,计算所得产品中绿矾的质量分数为92.7%.
2.下列事实不用原电池原理解释的是( )
| A. | 轮船水线以下的船壳上装一定数量的锌块 | |
| B. | 红热的铁丝与冷水接触,表面形成蓝黑色保护层 | |
| C. | 纯锌与稀硫酸反应时,滴入少量CuSO4溶液后反应速率加快 | |
| D. | 烧过菜的铁锅加入清水放置,出现红棕色的锈斑 |
