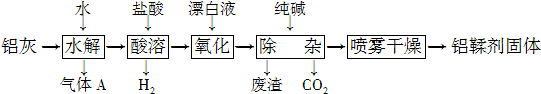
题目内容
7.短周期元素X、Y、Z、W的原子序数依次增大,X和Z同主族,Y和W同主族,原子半径X小于Y,四种元素原子最外层电子数之和为14.下列叙述正确的是( )| A. | 同周期元素中W的最高价氧化物对应水化物的酸性最强 | |
| B. | 氢化物的热稳定性:HnY>HnW | |
| C. | Y和X、Z和X组成的常见化合物中化学键的类型相同 | |
| D. | 原子半径的大小顺序:rW>rZ>rY>rX |
分析 短周期元素X、Y、Z、W的原子序数依次增大,X和Z同主族,Y和W同主族,原子半径X小于Y,则X处于Y的上一周期,四种元素原子最外层电子数之和为14,则X和Y的主族序数之和为7,X和Z同主族,且Z的原子序数大于Y,所以X是H元素,Y是O元素,Z是Na元素,W是S元素.
A.元素的非金属性越强其最高价含氧酸的酸性越强;
B.元素的非金属性越强,对应的氢化物越稳定;
C.活泼金属和活泼非金属之间易形成离子键,非金属元素之间易形成共价键;
D.电子层数越多,其原子半径越大,同一周期元素中,原子半径随着原子序数的增大而减小.
解答 解:短周期元素X、Y、Z、W的原子序数依次增大,X和Z同主族,Y和W同主族,原子半径X小于Y,则X处于Y的上一周期,四种元素原子最外层电子数之和为14,则X和Y的主族序数之和为7,X和Z同主族,且Z的原子序数大于Y,所以X是H元素,Y是O元素,Z是Na元素,W是S元素.
A.S属于第三周期元素,第三周期中非金属性最强的元素是Cl元素,所以Cl元素的最高价氧化物对应水化物的酸性最强,故A错误;
B.O元素的非金属性大于S,所以气态氢化物的热稳定性:H2O>H2S,故B正确;
C.O和H、Na和H组成的常见化合物中的化学键分别属于共价键和离子键,故C错误;
D.原子半径大小顺序是rZ>rW>rY>rX,故D错误;
故选B.
点评 本题考查学生利用原子结构的关系来推断元素,推断元素是解答本题的难点,应学会利用假设和验证的方法来解答.

练习册系列答案
相关题目
18.电解原理在化学工业中有着广泛的应用.图甲表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.则下列说法不正确的是( )
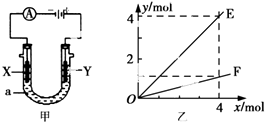
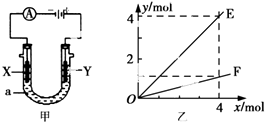
| A. | 若此装置用于电解精炼铜,则X为纯铜、Y为粗铜,电解的溶液a可以是硫酸铜或氯化铜溶液 | |
| B. | 按图甲装置用惰性电极电解AgNO3溶液,若图乙横坐标x表示流入电极的电子的物质的量,则E可表示反应生成硝酸的物质的量,F表示电解生成气体的物质的量 | |
| C. | 按图甲装置用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,加入0.5 mol的碳酸铜刚好恢复到通电前的浓度和pH,则电解过程中转移的电子为2.0 mol | |
| D. | 若X、Y为铂电极,a溶液为500 mL KCl和KNO3的混合液,经过一段时间后,两极均得到标准状况下11.2 L气体,则原混合液中KCl的物质的量浓度至少为2.0 mol•L-1 |
2.已知R是短周期元素,存在以下反应:RO3-+6I-+6H+═Rn-+3I2+3H2O.下列叙述正确的是( )
| A. | R是ⅤA族元素 | B. | n=2 | ||
| C. | R 是最外层有7个电子,只能是氯 | D. | Rn-还原性大于 I- |
12.有关AgCl的沉淀溶平衡体系,下列说法正确的是( )
| A. | AgCl的沉淀生成和溶解不断进行,但速率不相等 | |
| B. | AgCl难溶于水,溶液中没有Ag+和Cl- | |
| C. | 升高温度,AgCl的溶解度增大 | |
| D. | 向平衡体系中加入NaCl固体,AgCl的溶解度变小 |
19.实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的方程式如下:2KMnO4+16HCl(浓)═2KCl+2MnCl2+8H2O+5Cl2↑,下列说法正确的是( )
| A. | 氧化剂和还原剂的物质的量之比为1:8 | |
| B. | 当有1mol Cl2生成时,有0.5 mol电子发生转移 | |
| C. | 氧化产物是MnCl2,还原产物Cl2 | |
| D. | 相同物质的量的KMnO4和MnO2分别与足量浓盐酸充分反应产生Cl2质量之比为5:2. |
16.把一定量的铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+和Fe3+浓度之比为3:2.则已反应的Fe3+和未反应的Fe3+的物质的量之比为( )
| A. | 1:2 | B. | 2:3 | C. | 3:2 | D. | 1:1 |
17.设NA为阿伏加德罗常数的值,下列说法正确的组合是( )
a 12g 金刚石中含有的碳碳键的数目为2NA
b 1mol 明矾与水完全反应转化为氢氧化铝胶体后,其中胶体粒子的数目为NA
c 1mol Na2O2与水反应转移的电子数为NA
d 常温下,1mol•L-1的NH4NO3溶液中含有氮原子的数目为2NA
e 常温下,30g SiO2晶体中含有Si-O键的数目为NA
f 17g H2O2中含有的电子数为9NA
g 将2mol SO2与1mol O2混合,发生反应转移的电子总数一定是4NA
h 常温下,100mL 1mol•L-1 AlCl3溶液中阳离子总数大于0.1NA.
a 12g 金刚石中含有的碳碳键的数目为2NA
b 1mol 明矾与水完全反应转化为氢氧化铝胶体后,其中胶体粒子的数目为NA
c 1mol Na2O2与水反应转移的电子数为NA
d 常温下,1mol•L-1的NH4NO3溶液中含有氮原子的数目为2NA
e 常温下,30g SiO2晶体中含有Si-O键的数目为NA
f 17g H2O2中含有的电子数为9NA
g 将2mol SO2与1mol O2混合,发生反应转移的电子总数一定是4NA
h 常温下,100mL 1mol•L-1 AlCl3溶液中阳离子总数大于0.1NA.
| A. | a c f h | B. | a c e g | C. | a c e f h | D. | b d e h |