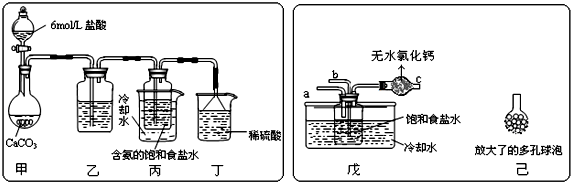
题目内容
12.化学与生产、生活和社会密切相关.下列说法正确的是( )| A. | 用米汤检验碘盐中的碘 | |
| B. | 用热的烧碱溶液洗涤餐具上的油污 | |
| C. | “地沟油”禁止食用,但可用来制取肥皂 | |
| D. | 将洁厕灵与84消毒液混合使用,能更有效的起到洁具除垢和卫生消毒作用 |
分析 A.淀粉遇碘变蓝色;
B.一般不用烧碱,因烧碱具有强腐蚀性;
C.地沟油主要成分为油脂,可发生造化反应;
D.洁厕灵与84消毒液混合使用可生成有毒气体氯气.
解答 解:A.淀粉遇碘变蓝色,淀粉与碘酸钾不反应,故A错误;
B.一般不用烧碱,因烧碱具有强腐蚀性,可用纯碱溶液,故B错误;
C.地沟油主要成分为油脂,可发生造化反应,可用于制备肥皂,故C正确;
D.洁厕灵与84消毒液混合使用可生成有毒气体氯气,易中毒,故D错误.
故选C.
点评 本题考查较为综合,涉及油脂的组成、淀粉的性质、氯气的化学性质,题目难度中等,注意掌握常见的有机物结构与性质,明确氯水的性质及应用,题目有利于培养学生良好的科学素养.

练习册系列答案
相关题目
3.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 1L 0.1mol/L的NaHS溶液中HS-和S2-离子数之和为0.1NA | |
| B. | 2.0 g H218O与D2O的混合物中所含中子数为NA | |
| C. | 1 mol Na2O2固体中含离子总数为4NA | |
| D. | 3 mol Fe在足量的水蒸气中完全反应转移9NA个电子 |
7.氧化铜矿用稀硫酸溶解后所得酸浸液(含Cu2+、H+、SO42-、Mg2+、A13+、Fe2+) 经下列流程可制得高纯度硫酸铜晶体如图1:
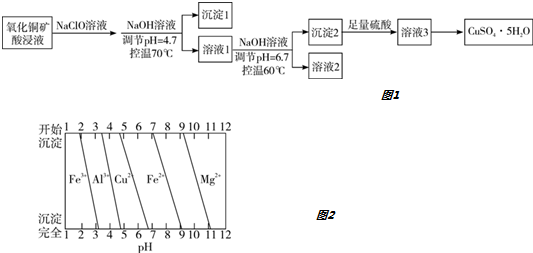
已知:该实验条件下,各金属离子沉淀的pH如图2所示.下列判断正确的是( )

已知:该实验条件下,各金属离子沉淀的pH如图2所示.下列判断正确的是( )
| A. | 沉淀1的主要成分为Al(OH)3和Fe(OH)3 | |
| B. | 溶液2中所含金属阳离子只有Mg2+ | |
| C. | 将溶液3蒸干即得CuSO4•5H2O晶体 | |
| D. | 若不加入NaClO溶液,对制得硫酸铜晶体的纯度将无影响 |
17.下列实验“操作”“现象”与“结论”都正确的是( )
| 1 | 操作 | 现象 | 结 论 |
| A | 向白色AgCl悬浊液中滴加0.1mol/LKI溶液 | 试管中白色沉淀转化为黄色沉淀. | Ksp(AgCl)>Ksp(AgI) |
| B | 向装有Fe(NO3)2溶液的试管中加入几滴稀H2SO4 | 溶液颜色基本不变 | Fe(NO3)2与H2SO4不反应 |
| C | 向Na2SiO3溶液中滴加盐酸 | 溶液变浑浊 | 非金属性:Cl>Si |
| D | SO2通入足量的稀Fe(NO3)3溶液 | 溶液由棕黄色变为浅绿色,后立即又变成棕黄色 | 氧化性:HNO3>H2SO4>Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
4.汽车尾气是造成雾霾天气的重要原因之一,尾气中的主要污染物为CxHy、NO、CO、SO2及固体颗粒物等.研究汽车尾气的成分及其发生的反应,可以为更好的治理汽车尾气提供技术支持.请回答下列问题:
(1)治理尾气中NO和CO的一种方法是:在汽车排气管上装一个催化转化装置,使二者发生反应转化成无毒无污染气体,该反应的化学方程式是2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2.
(2)活性炭也可用于处理汽车尾气中的NO.在1L恒容密闭容器中加入0.1000molNO和2.030mol固体活性炭,生成A、B两种气体,在不同温度下测得平衡体系中各物质的物质的量以及容器内压强如下表:
根据上表数据,写出容器中发生反应的化学方程式C+2NO?N2+CO2并判断p>3.93MPa(用“>”、“<“或“=”填空).计算反应体系在200℃时的平衡常数Kp=0.5625(用平衡分压代替平衡浓度计算,分压=总压×体积分数).
(3)汽车尾气中的SO2可用石灰水来吸收,生成亚硫酸钙浊液.常温下,测得某纯CaSO3与水形成的浊液pH为9,已知Kal(H2SO3)=1.8×10-2,Ka2(H2SO3)=6.0×10-9,忽略SO32-的第二步水解,则Ksp(CaSO3)=4.2×10-9.
(4)尾气中的碳氢化合物含有甲烷,其在排气管的催化转化器中可发生如下反应CH4(g)+H2O(1)?CO(g)+3H2 (g)△H=+250.1kJ.mol-l.已知CO(g)、H2(g)的燃烧热依次为283.0kJ.mol-1、285.8kJ.mol-1,请写出表示甲烷燃烧热的热化学方程式CH4(g)+2O2(g)→CO2(g)+2H2O(l)△H=-890.3KJ/mol.以CH4(g)为燃料可以设计甲烷燃料电池,该电 池以稀H2SO4作电解质溶液,其负极电极反应式为CH4-8e-+2H2O=CO2+8H+,已知该电池的能量转换效率为86.4%,则该电池的比能量为13.3kW.h.kg-1(结果保留1位小数,比能量=$\frac{电池输出电能(kW•h)}{燃料质量(kg)}$,lkW•h=3.6×1 06J).
(1)治理尾气中NO和CO的一种方法是:在汽车排气管上装一个催化转化装置,使二者发生反应转化成无毒无污染气体,该反应的化学方程式是2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2.
(2)活性炭也可用于处理汽车尾气中的NO.在1L恒容密闭容器中加入0.1000molNO和2.030mol固体活性炭,生成A、B两种气体,在不同温度下测得平衡体系中各物质的物质的量以及容器内压强如下表:
| 活性炭/mol | NO/mol | A/mol | B/mol | P/MPa | |
| 200℃ | 2.000 | 0.0400 | 0.0300 | 0.0300 | 3.93 |
| 335℃ | 2.005 | 0.0500 | 0.0250 | 0.250 | P |
(3)汽车尾气中的SO2可用石灰水来吸收,生成亚硫酸钙浊液.常温下,测得某纯CaSO3与水形成的浊液pH为9,已知Kal(H2SO3)=1.8×10-2,Ka2(H2SO3)=6.0×10-9,忽略SO32-的第二步水解,则Ksp(CaSO3)=4.2×10-9.
(4)尾气中的碳氢化合物含有甲烷,其在排气管的催化转化器中可发生如下反应CH4(g)+H2O(1)?CO(g)+3H2 (g)△H=+250.1kJ.mol-l.已知CO(g)、H2(g)的燃烧热依次为283.0kJ.mol-1、285.8kJ.mol-1,请写出表示甲烷燃烧热的热化学方程式CH4(g)+2O2(g)→CO2(g)+2H2O(l)△H=-890.3KJ/mol.以CH4(g)为燃料可以设计甲烷燃料电池,该电 池以稀H2SO4作电解质溶液,其负极电极反应式为CH4-8e-+2H2O=CO2+8H+,已知该电池的能量转换效率为86.4%,则该电池的比能量为13.3kW.h.kg-1(结果保留1位小数,比能量=$\frac{电池输出电能(kW•h)}{燃料质量(kg)}$,lkW•h=3.6×1 06J).
1.为防止NO2污染空气,科学家寻求合适的化合物G和催化剂,以实现反应:NO2+G $\stackrel{催化剂}{?}$N2+H2O+nZ (未配平,n可以为0),上述反应式中的G不可能是( )
| A. | CO | B. | NH3 | C. | H2O2 | D. | CH3CH2OH |

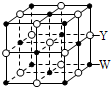 X、Y、Z、Q、R、W是原子序数依次增大的前四周期元素.X的原子核内无中子,Y与Z能形成两种无色无味的气体,Q与X同族,R在同周期主族元素中原子半径最小,基态原子W的3d能级有2个空轨道.请回答下列问题:
X、Y、Z、Q、R、W是原子序数依次增大的前四周期元素.X的原子核内无中子,Y与Z能形成两种无色无味的气体,Q与X同族,R在同周期主族元素中原子半径最小,基态原子W的3d能级有2个空轨道.请回答下列问题: