题目内容
一定条件下进行反应:COCl2(g)?Cl2(g)+CO(g),向2.0L恒容密闭容器中充入1.0 mol COCl2(g),经过一段时间后达到平衡.反应过程中测得的有关数据见下表:
下列说法正确的是( )
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
| A、A、保持其他条件不变,升高温度,平衡时c(Cl2)=0.22 mol?L-1,则反应的△H<0 |
| B、若在2 L恒容绝热(与外界没有热量交换)密闭容器进行该反应,化学平衡常数不变 |
| C、保持其他条件不变,起始向容器中充入1.2 molCOCl2、0.60 molCl2和0.60 molCO,反应达到平衡前的速率:v(正)<v(逆) |
| D、保持其他条件不变,起始向容器中充入1.0 molCl2和0.8 molCO,达到平衡时,Cl2的转化率小于60% |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:A.由表中数据可知,6s、8s时氯气的物质的量都是0.4mol,说明6s时反应到达平衡,平衡时氯气的浓度为0.2mol.L,升高温度,到达新平衡,氯气的浓度变为0.22mol/L,氯气浓度增大,说明平衡向生成氯气的方向移动;
B.恒容绝热密闭容器进行该反应,随反应进行温度发生变化,而平衡常数只受温度影响;
C.利用三段式计算平衡时各组分的平衡浓度,进而计算平衡常数,再计算此时的浓度商,根据浓度商与平衡常数大小判断反应进行方向,据此判断反应速率;
D.原平衡等效为起始向容器中充入1.0molCl2和1.0molCO,如加入1.0 mol Cl2和0.8 mol CO,相当于在上述等效平衡的基础上减小0.2molCO,平衡在原来的基础上向正反应方向移动,则Cl2的转化率减小.
B.恒容绝热密闭容器进行该反应,随反应进行温度发生变化,而平衡常数只受温度影响;
C.利用三段式计算平衡时各组分的平衡浓度,进而计算平衡常数,再计算此时的浓度商,根据浓度商与平衡常数大小判断反应进行方向,据此判断反应速率;
D.原平衡等效为起始向容器中充入1.0molCl2和1.0molCO,如加入1.0 mol Cl2和0.8 mol CO,相当于在上述等效平衡的基础上减小0.2molCO,平衡在原来的基础上向正反应方向移动,则Cl2的转化率减小.
解答:
解:A.由表中数据可知,6s、8s时氯气的物质的量都是0.4mol,说明6s时反应到达平衡,平衡时氯气的浓度为0.2mol.L,升高温度,到达新平衡,氯气的浓度变为0.22mol/L,氯气浓度增大,说明平衡向正反应方向移动,故正反应为吸热反应,即△H>0,故A错误;
B.正反应为吸热反应,恒容绝热密闭容器进行该反应,随反应进行温度降低,而平衡常数只受温度影响,故平衡常数一定发生变化,故B错误;
C.平衡时c(Cl2)=0.2mol/L,
COCl2(g)?Cl2(g)+CO(g)
起始(mol/L):0.5 0 0
转化(mol/L):0.2 0.2 0.2
平衡(mol/L):0.3 0.2 0.2
该温度下平衡常数k=
=0.013,
若起始向容器中充入1.2 molCOCl2、0.60 molCl2和0.60 molCO,此时Qc=
=0.15>0.13,则反应向逆反应方向移动,反应达到平衡前v正<v逆,故C正确;
D.原平衡等效为起始向容器中充入1.0molCl2和1.0molCO,达到平衡时Cl2的转化率=
×100%=60%,如加入1.0 mol Cl2和0.8 mol CO,相当于在原来的基础上减小0.2molCO,平衡在原来的基础上向正反应方向移动,则Cl2的转化率减小,则Cl2的转化率小于60%,故D正确.
故选CD.
B.正反应为吸热反应,恒容绝热密闭容器进行该反应,随反应进行温度降低,而平衡常数只受温度影响,故平衡常数一定发生变化,故B错误;
C.平衡时c(Cl2)=0.2mol/L,
COCl2(g)?Cl2(g)+CO(g)
起始(mol/L):0.5 0 0
转化(mol/L):0.2 0.2 0.2
平衡(mol/L):0.3 0.2 0.2
该温度下平衡常数k=
| 0.2×0.2 |
| 0.3 |
若起始向容器中充入1.2 molCOCl2、0.60 molCl2和0.60 molCO,此时Qc=
| ||||
|
D.原平衡等效为起始向容器中充入1.0molCl2和1.0molCO,达到平衡时Cl2的转化率=
| 1mol-0.4mol |
| 1mol |
故选CD.
点评:本题综合考查化学平衡的计算、等效平衡,难度较大,注意理解平衡常数的意义及应用,注意D选项中利用等效平衡思想进行解答.

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目
只用一种试剂就能将NH4Cl、NaCl、AlCl3、MgCl2四种无色透明溶液区别出来,这种试剂可以是( )
| A、氨水 | B、氯化钙溶液 |
| C、氢氧化钠溶液 | D、稀硫酸 |
能用于治疗胃酸过多的是( )
| A、胃舒平[主要成分Al(OH)3] |
| B、阿司匹林 |
| C、青霉素 |
| D、烧碱 |
蛋白质发生的下列过程中,可逆的是( )
| A、变性 | B、煮熟 |
| C、盐析 | D、加入浓硫酸 |
下列离子方程式正确的是( )
| A、0.01mol/L NH4Al(SO4)2溶液与0.02mol/L Ba(OH)2溶液等体积混合NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3?H2O | ||||
| B、Na2O2加入H218O中:2Na2O2+2H218O=4Na++4OH-+18O2↑ | ||||
C、NH4HCO3溶液与过量NaOH溶液共热:NH4++OH-
| ||||
D、浓硝酸中加入过量铁粉并加热:Fe+3NO3-+6H+
|
关于如图所示的原电池,下列说法正确的是( )
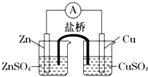

| A、锌是电池的负极,发生还原反应 |
| B、盐桥中的阳离子向硫酸铜溶液中迁移 |
| C、电流从锌电极通过检流计流向铜电极 |
| D、铜电极上发生的电极反应是2H++e-=H2↑ |
 甲、乙、丙、丁、戊、己为原子序数依次增大的短周期主族元素.甲、丙处于同一主族,丙、丁、戊处于同一周期,乙元素最高化合价与最低价的代数和为0;丙、丁、戊的最高价氧化物的水化物之间都能发生反应.用化学用语回答下列问题:
甲、乙、丙、丁、戊、己为原子序数依次增大的短周期主族元素.甲、丙处于同一主族,丙、丁、戊处于同一周期,乙元素最高化合价与最低价的代数和为0;丙、丁、戊的最高价氧化物的水化物之间都能发生反应.用化学用语回答下列问题: