题目内容
13.有一包固体,可能由硝酸铜、硫酸钠、氯化钠、碳酸氢钠、氢氧化钠中的一种或几种组成.为了探究该固体的组成,某化学小组设计并开展如图所示实验: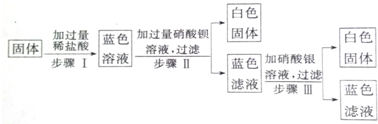
已知:①步骤Ⅰ中固体全部消失,溶液呈蓝色,且无气泡产生.②步骤Ⅱ、Ⅲ中均可观察到有白色沉淀生成.
请回答下列问题.
(1)原固体中一定含有的物质是Cu(NO3)2、Na2SO4(填化学式).
(2)原固体中一定不含有的物质是NaHCO3(填化学式).
(3)写出步骤Ⅱ、Ⅲ中生成白色沉淀的离子方程式ⅡBa2++SO42-=BaSO4↓、ⅢCl-+Ag+=AgCl↓.
(4)步骤Ⅲ所得蓝色滤液中一定含有的溶质是Ba(NO3)2、Cu(NO3)2、NaNO3、HNO3(填化学式).
分析 根据固体加过量稀盐酸,固体完全溶解且溶液呈蓝色,说明固体中一定有硝酸铜;又因为无气泡产生,所以固体中一定不含有碳酸氢钠;步骤Ⅱ加入过量硝酸钡产生白色沉淀,说明固体中一定含有硫酸钠;步骤Ⅲ中加入硝酸银溶液,出现白色沉淀,则该白色沉淀为氯化银,由于一开始加入过量稀盐酸,所以溶液中一定有氯离子,所以会生成氯化银沉淀,但不能确定一定含有氯化钠.
解答 解:(1)固体加过量稀盐酸,固体完全溶解且溶液呈蓝色,说明固体中一定有硝酸铜;步骤Ⅱ加入过量硝酸钡产生白色沉淀,说明固体中一定含有硫酸钠,
故答案为:Cu(NO3)2、Na2SO4;
(2)固体加过量稀盐酸无气泡产生,所以固体中一定不含有NaHCO3,故答案为:NaHCO3;
(3)根据向固体加过量稀盐酸,固体完全溶解且溶液呈蓝色,说明固体中一定有硝酸铜,硝酸铜溶于水,所以蓝色滤液中一定含有硝酸铜和硝酸;加入过量硝酸钡,说明硝酸钡有剩余,所以蓝色滤液中一定含有硝酸钡;硝酸钡和硫酸钠反应生成硝酸钠和硫酸钡沉淀,化学方程式是Ba2++SO42-=BaSO4↓,最后加入硝酸银,产生的白色沉淀是
氯化银,即Cl-+Ag+=AgCl↓,故答案为:Ba2++SO42-=BaSO4↓;Cl-+Ag+=AgCl↓;
(4)根据向固体加过量稀盐酸,固体完全溶解且溶液呈蓝色,说明固体中一定有硝酸铜,硝酸铜溶于水,所以蓝色滤液中一定含有硝酸铜和硝酸;加入过量硝酸钡,说明硝酸钡有剩余,所以蓝色滤液中一定含有硝酸钡;硝酸钡和硫酸钠反应生成硝酸钠和硫酸钡沉淀,所以蓝色滤液中一定含有硝酸钠,综合分析可知,蓝色滤液中一定含有的溶质是:硝酸、硝酸钠、硝酸钡、硝酸铜.
故答案为:Ba(NO3)2、Cu(NO3)2、NaNO3、HNO3.
点评 在解此类题时,首先分析所给混合物中各物质的性质,然后根据题中所给的实验现象进行判断,最后确定混合物的组成成分.

| A. | 水泥、陶瓷、玻璃是三大重要的硅酸盐产品 | |
| B. | 水玻璃是建筑行业经常使用的黏合剂 | |
| C. | 高纯度的硅被用于制作光导纤维 | |
| D. | 水晶、石英的主要成分是SiO2 |
| A. | 95℃纯水的pH<7,说明加热可导致水呈酸性 | |
| B. | pH=3的醋酸溶液,稀释至10倍后pH=4 | |
| C. | 0.2 mol•L-1的盐酸与等体积水混合后pH=1 | |
| D. | pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后pH=7 |
(1)硝酸尾气吸收法是利用碱溶液吸收汽车尾气,该方法的优点是对尾气进行回收利用,减小污染.
(2)使用复分解法制备硝酸钠的流程如下:

①反应器和除钙器中发生反应的化学方程式分别为:Ca(NO3)2+Na2SO4=CaSO4↓+2NaNO3;Na2CO3+Ca(NO3)2=CaCO3↓+2NaNO3.
②酸化槽中,应加硝酸调节pH=7,才能使杂质除去,又减少硝酸的浪费;为提高酸化除杂的效率,除了适当提高硝酸浓度外,还可以采取的措施是可以搅拌、适当升高温度.
③研究生产过程中水、硫酸钠、碳酸钠的用量与硝酸钠浸出率之间的关系,其中水加入量对硝酸钠浸出率的影响的实验结果见下表:
| 水/硝酸钙 | 0.8:1 | 0.9:1 | 0.95:1 | 1:1 | 1.05:1 | 1.1:1 | 1.15:1 |
| 浸出率/% | 83.1 | 94.5 | 98.2 | 99.1 | 99.5 | 99.6 | 99.7 |
(3)用硝酸钠、木炭、硫磺也可以制得威力巨大的火药,爆炸时产生一种单质,一种氧化物以及一种金属硫化物,其中,除硝酸钠之外,另外一种氧化剂和还原剂的比为1:3,请写出该反应的方程式2NaNO3+S+3C=Na2S+N2↑+3CO2↑,.
(4)硝酸钠在加热条件下发生分解产生亚硝酸钠(NaNO2),某同学进行该实验得到粗产品,取2.000g产品配成l00.00mL溶液,取25.00mL溶液,用0.l000mol/L的酸性高锰酸钾溶液进行滴定,重复实验4次,平均消耗酸性高锰酸钾溶液的体积为19.50mL,则粗产品中亚硝酸钠的质量百分含量为为67.27%.
(摩尔质量:NaNO2-69g/mol)
| A. | 30% | B. | 60% | C. | 40% | D. | 80% |
| A. | 加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铝粉 | |
| B. | 加入氢氧化钠溶液,通过分液的方法,可以除去苯中的乙酸 | |
| C. | 将氢气和氧气的混合气体通过灼热的氧化铜,以除去其中的氢气 | |
| D. | 用萃取的方法分离汽油和煤油 |
 甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源.
甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源.