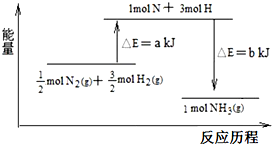题目内容
20.阅读下表短周期主族元素的相关系信息.| 元素代号 | 相关信息 |
| A | A的单质能与冷水剧烈反应,得到强碱性溶液 |
| B | B的原子最外层电子数是其内层电子数的三倍 |
| C | 在第3周期元素中,C的离子半径简单最小 |
| D | A、B、D组成的36电子的化合物X是家用消毒剂的主要成分 |
| E | 所有有机物中都含有E元素 |
(1)写出E在元素周期表中的位置:第二周期第ⅣA族;C的简单离子的结构示意图:
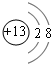 .
.(2)X的化学式为NaClO.
(3)A、B、C三种元素的简单离子的半径由大到小的顺序为O2->Na+>Al3+(用离子符号表示).
(4)A、B两元素组成的化合物A2B2属于离子化合物(填“离子”或“共价”“化合物”).存在的化学键是离子键、共价键.
(5)C元素形成的单质能与A的最高价氧化物水合物反应,其离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
分析 短周期主族元素中,A的单质能与冷水剧烈反应,得到强碱性溶液,则A为Na;B的原子最外层电子数是其内层电子数的三倍,原子最外层电子数不超过8,原子只能有2个电子层,最外层电子数为6,故B为O元素;在第3周期元素中,C的离子半径简单最小,则C为Al;A、B、D组成的36电子的化合物X是家用消毒剂的主要成分,X为NaClO,D为Cl元素;所有有机物中都含有E元素,E为碳元素.
解答 解:短周期主族元素中,A的单质能与冷水剧烈反应,得到强碱性溶液,则A为Na;B的原子最外层电子数是其内层电子数的三倍,原子最外层电子数不超过8,原子只能有2个电子层,最外层电子数为6,故B为O元素;在第3周期元素中,C的离子半径简单最小,则C为Al;A、B、D组成的36电子的化合物X是家用消毒剂的主要成分,X为NaClO,D为Cl元素;所有有机物中都含有E元素,E为碳元素.
(1)E为碳元素,原子有2个电子层,最外层电子数为4,处于周期表中第二周期第ⅣA族;C为铝元素,铝离子核外电子数为10,有2个电子层,最外层电子数为8,离子结构示意图为 ,
,
故答案为:第二周期第ⅣA族; ;
;
(2)有上述分析可知,X为NaClO,故答案为:NaClO;
(3)A、B、C三种元素形成的简单离子分别为Na+、O2-、Al3+,离子的电子层排布相同,核电荷数越大,离子半径越小,所以离子半径由大到小的顺序为O2->Na+>Al3+,
故答案为:O2->Na+>Al3+;
(4)A、B两元素组成的化合物Na2O2属于离子化合物,存在的化学键有离子键、共价键,
故答案为:离子化合物;离子键、共价键;
(5)C元素形成的单质能与A的最高价氧化物水合物反应,其离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
点评 本题考查结构性质位置关系、常用化学用语、微粒半径比较等,难度中等,掌握元素化合物性质、原子结构推断元素是解题的关键.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| 元素编号 | 元素特征信息 |
| A | 阳离子核外无电子 |
| B | 最高正价和最低负价的绝对值之差为2 |
| C | 最外层电子数是内层电子数的3倍 |
| D | 1molD单质能与冷水反应,在标准状况下生成11.2LH2 |
| E | 原子最外层电子数等于其周期序数 |
| F | 负二价阴离子的电子层结构与Ar原子相同 |
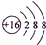 ;
;(2)E在周期表中的位置为第三周期ⅢA族;
(3)C和D简单离子的半径大小为O2->Na+;(用离子符号和“>”、“=”或“<”表示)
(4)元素非金属性强弱比较有很多方法,其中C和F的非金属性强弱的研究方案中不可行的是bc(填序号);
a.比较两种单质的颜色 b.比较氢化物的稳定性
c.依据两元素在周期表中的位置 d.依据两元素单质在自然界中的存在状态
(5)A、C、D三种元素组成的化合物中含有的化学键为共价键.
| A. | 碘和干冰的升华 | B. | 二氧化硅和生石灰的熔化 | ||
| C. | 氯化钠和铁的熔化 | D. | 乙醇的蒸发和氧化铝的熔化 |
①苯不能使溴水因反应而褪色证明没有碳碳双键?
②苯分子中碳碳之间的键长均相等证明苯分子无单双键交替结构?
③甲苯是苯的同系物,均不能使酸性高锰酸钾溶液褪色
④间二氯苯没有同分异构体证明了苯分子不是单双键交替
⑤硝基苯中含有苯、浓硝酸、浓硫酸杂质,除杂方法是向其中加入氢氧化钠溶液后分液.
| A. | ①②③ | B. | ②③ | C. | ①② | D. | ④⑤ |
| A. | 28g乙烯所含共用电子对数目为4NA | |
| B. | 1mol CH3+所含的电子总数为10NA | |
| C. | 0.5 mol苯分子中含有C=C双键数为1.5 NA | |
| D. | 标准状况下,11.2 L由CH4和C2H4组成的混合气体中含有氢原子的数目为2NA |
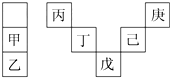 甲~庚等元素在周期表中的相对位置如表所示.己的最高价氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断正确的是( )
甲~庚等元素在周期表中的相对位置如表所示.己的最高价氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断正确的是( )| A. | 丙与戊的原子序数相差28 | |
| B. | 气态氢化物的稳定性:庚<己<戊 | |
| C. | 常温下,甲和乙的单质均能与水剧烈反应 | |
| D. | 丁的最高价氧化物是人类将太阳能转换为电能的常用材料 |
(1)将PM2.5样本用蒸馏水处理制成待测试样,若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离 子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)为减少SO2的排放,可洗涤含SO2的烟气,下列物质可作洗涤剂的是ab(填字母).
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(3)①已知汽缸中生成NO的反应为N2(g)+O2(g)?2NO(g)△H>0,汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是吸热反应,温度升高,平衡正向移动,NO的含量增大.
、汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)═2C(s)+O2(g).已知该反应的△H>0,简述该设想能否实现的依据△H>0△S<0,则在任何温度下△G>0,不可能自发进行.
 . (加聚反应)
. (加聚反应) . (取代反应)
. (取代反应)