题目内容
11.下列各组物质气化或熔化时,所克服的粒子间的作用(力)属同种类型的是( )| A. | 碘和干冰的升华 | B. | 二氧化硅和生石灰的熔化 | ||
| C. | 氯化钠和铁的熔化 | D. | 乙醇的蒸发和氧化铝的熔化 |
分析 A.碘和干冰都属于分子晶体,存在分子间作用力;
B.二氧化硅为原子晶体,生石灰属于离子晶体;
C.氯化钠属于离子晶体,铁属于金属晶体;
D.乙醇属于分子晶体,氧化铝属于离子晶体.
解答 解:A.碘和干冰都属于分子晶体,存在分子间作用力,碘和干冰的升华时克服的都是分子间作用力,故A正确;
B.二氧化硅为原子晶体,生石灰属于离子晶体,熔化时克服的作用力不同,故B错误;
C.氯化钠属于离子晶体,铁属于金属晶体,熔化时克服的作用力不同,故C错误;
D.乙醇属于分子晶体属于分子晶体,存在分子间作用力,氧化铝属于离子晶体,存在离子键,熔化时克服的作用力不同,故D错误.
故选A.
点评 本题考查不同晶体的结构微粒及微粒间作用力的区别,题目难度不大,注意晶体类型的判断,侧重于考查学生对基础知识的应用能力.

练习册系列答案
 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目
1.榄香烯是一种新型的抗癌药,它的结构简式如图,有关说法正确的是( )


| A. | 榄香烯的分子式为C15H20 | |
| B. | 榄香烯属于芳香烃 | |
| C. | 1 mol 榄香烯最多能和6 mol H2反应 | |
| D. | 榄香烯能使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色 |
19.为提纯表中的物质(括号内为杂质),有关除杂试剂和分离方法的选择均正确的是( )
| 编号 | 被提纯物质 | 除杂试剂 | 分离方法 |
| ① | 苯甲酸(不溶于水的杂质) | 水 | 过滤、重结晶 |
| ② | 乙酸乙酯(醋酸) | 氢氧化钠溶液 | 分液 |
| ③ | 乙醇(4%的水) | 生石灰 | 蒸馏 |
| ④ | 二氧化碳(氯化氢) | 饱和碳酸钠溶液 | 洗气 |
| A. | ①② | B. | ①③ | C. | ②③ | D. | ③④ |
6.与铝反应能放出氢气的溶液中,下列哪组离子可能与其大量共存( )
| A. | K+、Na+、SO42-、CO32- | B. | NH4+、Mg2+、SO32-、Cl- | ||
| C. | Na+、K+、HCO3-、Cl- | D. | K+、Cu2+、CO32-、NO3- |
16.下列变化属于吸热反应的是( )
| A. | 碘的升华 | B. | Ba(OH)2•8H2O与NH4Cl混合搅拌 | ||
| C. | 生石灰与水反应 | D. | 浓硫酸稀释 |
20.阅读下表短周期主族元素的相关系信息.
请回答:
(1)写出E在元素周期表中的位置:第二周期第ⅣA族;C的简单离子的结构示意图: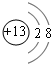 .
.
(2)X的化学式为NaClO.
(3)A、B、C三种元素的简单离子的半径由大到小的顺序为O2->Na+>Al3+(用离子符号表示).
(4)A、B两元素组成的化合物A2B2属于离子化合物(填“离子”或“共价”“化合物”).存在的化学键是离子键、共价键.
(5)C元素形成的单质能与A的最高价氧化物水合物反应,其离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
| 元素代号 | 相关信息 |
| A | A的单质能与冷水剧烈反应,得到强碱性溶液 |
| B | B的原子最外层电子数是其内层电子数的三倍 |
| C | 在第3周期元素中,C的离子半径简单最小 |
| D | A、B、D组成的36电子的化合物X是家用消毒剂的主要成分 |
| E | 所有有机物中都含有E元素 |
(1)写出E在元素周期表中的位置:第二周期第ⅣA族;C的简单离子的结构示意图:
 .
.(2)X的化学式为NaClO.
(3)A、B、C三种元素的简单离子的半径由大到小的顺序为O2->Na+>Al3+(用离子符号表示).
(4)A、B两元素组成的化合物A2B2属于离子化合物(填“离子”或“共价”“化合物”).存在的化学键是离子键、共价键.
(5)C元素形成的单质能与A的最高价氧化物水合物反应,其离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
1.下列存在顺反异构的有机物是( )
| A. | CH3CH=CH2 | B. | Br2C=CHCH2COOH | C. |  | D. |  |
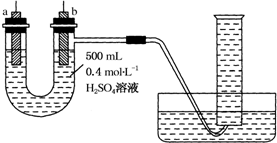 实验室提供纯锌、纯铜片和500mL 0.4mol•L-1的H2SO4溶液、导线、1 000mL量筒.试用如图装置来测定锌和稀硫酸反应时在某段时间内通过导线的电子的物质的量.
实验室提供纯锌、纯铜片和500mL 0.4mol•L-1的H2SO4溶液、导线、1 000mL量筒.试用如图装置来测定锌和稀硫酸反应时在某段时间内通过导线的电子的物质的量.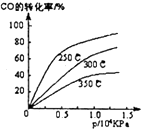 工业合成甲醇反应如下:CO(g)+2H2(g)?CH3OH(g);△H请回答下列问题:
工业合成甲醇反应如下:CO(g)+2H2(g)?CH3OH(g);△H请回答下列问题: