题目内容
15.写出下列反应的化学方程式,并注明的反应类型(1)由丙烯制备聚丙烯的反应
 . (加聚反应)
. (加聚反应)(2)制TNT的反应
 . (取代反应)
. (取代反应)(3)2-甲基-2-溴丙烷与NaOH的乙醇溶液共热CBr(CH3)3+NaOH$\stackrel{醇}{→}$C(CH3)2=CH2↑+NaBr. (消去反应)
(4)2--二甲基丙醇和氧气在铜存在下加热2CH(CH3)2CH2OH+O2$→_{△}^{Cu/Ag}$2CH(CH3)2CHO+2H2O. (氧化反应).
分析 (1)丙烯分子含有碳碳双键,发生加聚反应生成聚丙烯;
(2)甲苯与浓硝酸发生取代反应可生成TNT,即三硝基甲苯;
(3)2-甲基-2-溴丙烷在NaOH醇溶液中发生消去反应生成2-甲基丙烯;
(4)2-甲基丙醇与氧气在铜催化作用下反应,醇羟基和醇羟基相连的碳分别脱氢生成醛.
解答 解:(1)丙烯能发生加聚反应得到聚丙烯,方程式为 ,
,
故答案为: ;加聚反应;
;加聚反应;
(2)甲苯与浓硝酸发生取代反应可生成TNT,即三硝基甲苯,反应的化学方程式为 ,
,
故答案为: ;取代反应;
;取代反应;
(3)2-甲基-2-溴丙烷在NaOH醇溶液中发生消去反应生成2-甲基丙烯,反应的方程式为:CBr(CH3)3+NaOH$\stackrel{醇}{→}$C(CH3)2=CH2↑+NaBr,
故答案为:CBr(CH3)3+NaOH$\stackrel{醇}{→}$C(CH3)2=CH2↑+NaBr;消去反应;
(4)2-甲基丙醇与氧气在铜催化作用下发生氧化反应,反应生成丙酮,反应的方程式为:2CH(CH3)2CH2OH+O2$→_{△}^{Cu/Ag}$2CH(CH3)2CHO+2H2O,
故答案为:2CH(CH3)2CH2OH+O2$→_{△}^{Cu/Ag}$2CH(CH3)2CHO+2H2O;氧化反应.
点评 本题考查了方程式的书写和反应类型,根据反应物、生成物和反应条件书写方程式,明确发生的化学反应原理是解答本题的关键,注意常见有机物的性质,题目难度不大.

练习册系列答案
相关题目
5.下列各项内容中,排列顺序正确的是( )
①固体的热稳定性:Na2CO3>CaCO3>NaHCO3
②物质的熔点Li>Na>K
③微粒半径:K+>S2->F-
④单质的密度Na<K<Rb
⑤氢化物的沸点:H2Se>H2S>H2O.
①固体的热稳定性:Na2CO3>CaCO3>NaHCO3
②物质的熔点Li>Na>K
③微粒半径:K+>S2->F-
④单质的密度Na<K<Rb
⑤氢化物的沸点:H2Se>H2S>H2O.
| A. | ①③⑤ | B. | ①②④ | C. | ④⑤ | D. | ①② |
6.与铝反应能放出氢气的溶液中,下列哪组离子可能与其大量共存( )
| A. | K+、Na+、SO42-、CO32- | B. | NH4+、Mg2+、SO32-、Cl- | ||
| C. | Na+、K+、HCO3-、Cl- | D. | K+、Cu2+、CO32-、NO3- |
20.阅读下表短周期主族元素的相关系信息.
请回答:
(1)写出E在元素周期表中的位置:第二周期第ⅣA族;C的简单离子的结构示意图: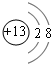 .
.
(2)X的化学式为NaClO.
(3)A、B、C三种元素的简单离子的半径由大到小的顺序为O2->Na+>Al3+(用离子符号表示).
(4)A、B两元素组成的化合物A2B2属于离子化合物(填“离子”或“共价”“化合物”).存在的化学键是离子键、共价键.
(5)C元素形成的单质能与A的最高价氧化物水合物反应,其离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
| 元素代号 | 相关信息 |
| A | A的单质能与冷水剧烈反应,得到强碱性溶液 |
| B | B的原子最外层电子数是其内层电子数的三倍 |
| C | 在第3周期元素中,C的离子半径简单最小 |
| D | A、B、D组成的36电子的化合物X是家用消毒剂的主要成分 |
| E | 所有有机物中都含有E元素 |
(1)写出E在元素周期表中的位置:第二周期第ⅣA族;C的简单离子的结构示意图:
 .
.(2)X的化学式为NaClO.
(3)A、B、C三种元素的简单离子的半径由大到小的顺序为O2->Na+>Al3+(用离子符号表示).
(4)A、B两元素组成的化合物A2B2属于离子化合物(填“离子”或“共价”“化合物”).存在的化学键是离子键、共价键.
(5)C元素形成的单质能与A的最高价氧化物水合物反应,其离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
7.下列哪些能源属于二次能源( )
| A. | 风力 | B. | 电力 | C. | 原煤 | D. | 流水 |
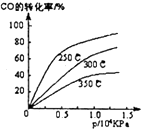 工业合成甲醇反应如下:CO(g)+2H2(g)?CH3OH(g);△H请回答下列问题:
工业合成甲醇反应如下:CO(g)+2H2(g)?CH3OH(g);△H请回答下列问题:
 .
.
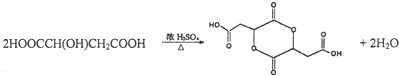 .
.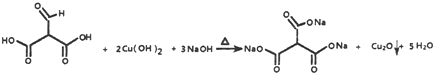 .
.
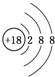 .元素K名称为氯在周期表中的位置第三周期第ⅦA族.
.元素K名称为氯在周期表中的位置第三周期第ⅦA族.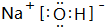
 HClO+HCl.
HClO+HCl.