题目内容
12.设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )| A. | 28g乙烯所含共用电子对数目为4NA | |
| B. | 1mol CH3+所含的电子总数为10NA | |
| C. | 0.5 mol苯分子中含有C=C双键数为1.5 NA | |
| D. | 标准状况下,11.2 L由CH4和C2H4组成的混合气体中含有氢原子的数目为2NA |
分析 A.乙烯分子中含有1个碳碳双键、4个碳氢键,总共含有6个共用电子对;
B.1mol CH3+所含的电子总数为8NA;
C.苯分子中的碳碳键为一种介于碳碳单键和双键之间的独特键,不存在碳碳双键;
D.求出CH4和C2H4混合物的物质的量,然后根据两者均含4个氢原子来分析.
解答 解:A.28g乙烯的物质的量为1mol,1mol乙烯中含有2mol碳碳共用电子对、4mol碳氢共用电子对,总共含有6mol共用电子对,所含共用电子对数目为6NA,故A错误;
B.CH3+中含8个电子,1mol CH3+所含的电子总数为8NA,故B错误;
C.苯分子中的碳碳键为一种独特键,不存在碳碳双键,故C错误;
D.标况下11.2LCH4和C2H4混合物的物质的量为0.5mol,而两者均含4个氢原子,故0.5mol混合物中含2mol氢原子即2NA个,故D正确.
故选D.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意标况下戊烷、乙醇、水等的状态不是气体,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案
相关题目
20.阅读下表短周期主族元素的相关系信息.
请回答:
(1)写出E在元素周期表中的位置:第二周期第ⅣA族;C的简单离子的结构示意图: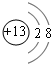 .
.
(2)X的化学式为NaClO.
(3)A、B、C三种元素的简单离子的半径由大到小的顺序为O2->Na+>Al3+(用离子符号表示).
(4)A、B两元素组成的化合物A2B2属于离子化合物(填“离子”或“共价”“化合物”).存在的化学键是离子键、共价键.
(5)C元素形成的单质能与A的最高价氧化物水合物反应,其离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
| 元素代号 | 相关信息 |
| A | A的单质能与冷水剧烈反应,得到强碱性溶液 |
| B | B的原子最外层电子数是其内层电子数的三倍 |
| C | 在第3周期元素中,C的离子半径简单最小 |
| D | A、B、D组成的36电子的化合物X是家用消毒剂的主要成分 |
| E | 所有有机物中都含有E元素 |
(1)写出E在元素周期表中的位置:第二周期第ⅣA族;C的简单离子的结构示意图:
 .
.(2)X的化学式为NaClO.
(3)A、B、C三种元素的简单离子的半径由大到小的顺序为O2->Na+>Al3+(用离子符号表示).
(4)A、B两元素组成的化合物A2B2属于离子化合物(填“离子”或“共价”“化合物”).存在的化学键是离子键、共价键.
(5)C元素形成的单质能与A的最高价氧化物水合物反应,其离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
7.下列哪些能源属于二次能源( )
| A. | 风力 | B. | 电力 | C. | 原煤 | D. | 流水 |
17.下列方程式书写完全正确的是( )
| A. | 苯酚钠溶液中通入过量二氧化碳:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| B. | 溴乙烷的消去反应:C2H5Br+OH-$→_{△}^{水}$C2H4↑+Br-+H2O | |
| C. | 乙醇催化氧化成乙醛:2C2H5OH+O2$→_{△}^{Cu或Ag}$2CH3CHO+2H2O | |
| D. | 乙酸乙酯在碱性条件下水解:CH3COOC2H5+H2O?CH3COOH+C2H5OH |
1.下列存在顺反异构的有机物是( )
| A. | CH3CH=CH2 | B. | Br2C=CHCH2COOH | C. |  | D. |  |
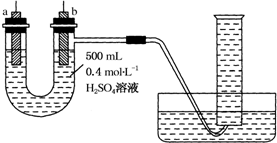 实验室提供纯锌、纯铜片和500mL 0.4mol•L-1的H2SO4溶液、导线、1 000mL量筒.试用如图装置来测定锌和稀硫酸反应时在某段时间内通过导线的电子的物质的量.
实验室提供纯锌、纯铜片和500mL 0.4mol•L-1的H2SO4溶液、导线、1 000mL量筒.试用如图装置来测定锌和稀硫酸反应时在某段时间内通过导线的电子的物质的量.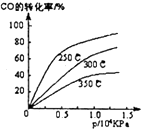 工业合成甲醇反应如下:CO(g)+2H2(g)?CH3OH(g);△H请回答下列问题:
工业合成甲醇反应如下:CO(g)+2H2(g)?CH3OH(g);△H请回答下列问题: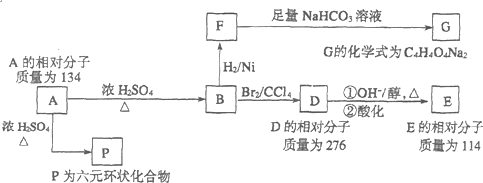
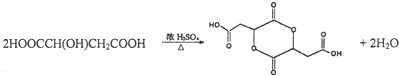 .
.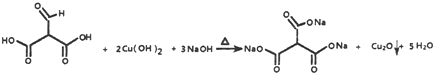 .
.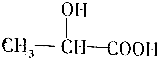 ,
,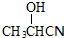 .
.