题目内容
17.“雾霾”成为人们越来越关心的环境问题.雾霾中含有二氧化硫、氮氧化物和可吸入颗粒物等污染性物质.请回答下列问题:(1)汽车尾气是雾霾形成的原因之一.尾气治理可用汽油中挥发出来的烃类物质
(CxHy)催化还原尾气中的NO气体,该过程的化学方程式为4CxHy+(8x+2y)NO=4XCO2+(4x+y)N2+2yH2O.
(2)冬季燃煤供暖产生的废气也是雾霾的主要来源之一.经研究发现将煤炭在$\frac{{O}_{2}}{C{O}_{2}}$的气氛下燃烧,能够降低燃煤时NO的排放,主要反应为:2NO(g)+2CO(g)?N2(g)+2CO2(g).
2NO(g)+2CO(g)?N2(g)+2CO2 (g)△H
已知:
①N2(g)+O2(g)?2NO(g)△H1=+180.5kJ•mol-1
②2CO(g)?2C(s)+O2(g)△H2=+221kJ•mol-1
③C(s)+O2(g)?CO2(g)△H3=-393.5kJ•mol-1
则△H=-746.5kJ•mol-1
(3)某研究小组用NaOH溶液吸收尾气中的二氧化硫,将得到的Na2SO3溶液进行电解,其中阴阳膜组合电解装置如图一所示,电极材料为石墨.
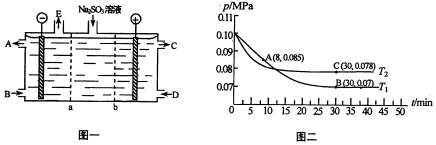
①a表示阳离子交换膜(填“阴”或“阳”).A-E分别代表生产中的原料或产品.其中C为硫酸,则A表示NaOH溶液.E表示氢气.
②阳极的电极反应式为SO32--2e-+H2O=2H++SO42-.
(4)SO2经过净化后与空气混合进行催化氧化可制取硫酸,其中SO2发生催化氧化的
反应为:2SO2(g)+O2(g)?2SO3(g).若在T1℃、0.1MPa条件下,往一密闭容器通入SO2和O2[其中n(SO2):n(O2)=2:1],测得容器内总压强与反应时间如图二所示.
①图中A点时,SO2的转化率为45%.
②在其他条件不变的情况下,测得T2℃时压强的变化曲线如图所示,刻C点的正反应
速率vc(正)与A点的逆反应速率vc (逆)的大小关系为vc(正)>vc (逆) (填“>”、“<”或“=”)
③图中B点的压强平衡常数kp=(用平衡分压代替平衡浓度计算.分压=总压×物质的量分数).
分析 (1)(CxHy)催化还原尾气中的NO气体生成氮气、二氧化碳和水,结合原子守恒配平书写化学方程式;
(2)②×2+③×2-①得到2NO(g)+2CO(g)?N2(g)+2CO2(g),据此计算反应的焓变;
(3)①从C为硫酸可知,b为阴离子交换膜.故a为阳离子交换膜.在阴极区应为水放电生成氢气和氢氧根,故A为氢氧化钠,E为氢气;
②阳极应为亚硫酸根放电生成硫酸根,写出即可;
(4)①结合化学三行计算列式,依据图中A点时,气体物质的量0.085,依据开始和A点气体物质的量之比列式计算,转化率=$\frac{消耗量}{起始量}$×100%;
②先拐先平温度高,达到平衡所需时间短,温度越高反应速率越大;
③图中B点,依据化学三行列式计算用平衡分压代替平衡浓度计算,分压=总压×物质的量分数计算SO2催化氧化反应在图中B点的压强平衡常数.
解答 解:(1)(CxHy)催化还原尾气中的NO气体生成氮气、二氧化碳和水,结合原子守恒配平书写化学方程式为:4CxHy+(8x+2y)NO=4XCO2+(4x+y)N2+2yH2O,
故答案为:4CxHy+(8x+2y)NO=4XCO2+(4x+y)N2+2yH2O;
(2)②×2+③×2-①得到2NO(g)+2CO(g)?N2(g)+2CO2(g),反应的焓变=2(+110.5kJ•mol-1)+2(-393.5kJ•mol-1)-(180.5kJ•mol-1)=-746.5kJ•mol-1,
故答案为:-746.5kJ•mol-1;
(3)①从C为硫酸可知,硫酸根来源于亚硫酸根放电.故b为阴离子交换膜,a为阳离子交换膜,在阴极区应为水放电生成氢气和氢氧根离子,故A为氢氧化钠,E为氢气,
故答案为:阳;NaOH溶液;氢气;
②阳极应为亚硫酸根放电生成硫酸根,反应的离子方程式为SO32--2e-+H2O=2H++SO42-,
故答案为:SO32--2e-+H2O=2H++SO42-;
(4)①依据化学三行列式计算,设氧气消耗物质的量为x,
2SO2(g)+O2(g)?2SO3
起始量(mol) 2a a 0
变化量(mol) 2x x 2x
平衡量(mol)2a-2x a-x 2x
图中A点时,气体物质的量0.085,则$\frac{2a-2x+a-x+2x}{2a+a}$=$\frac{0.085}{0.1}$,x=0.45a
SO2的转化率=$\frac{0.45a×2}{2a}$×100%=45%,
故答案为:45%;
②图象分析可知,先拐先平温度高则T1<T2,C点是平衡状态,A点反应未达到平衡状态,其中C点的正反应速率vC(正)与A点的逆反应速率vA(逆)的大小关系为vC(正)>vA(逆)
故答案为:>;
③图中B点,依据化学三行列式计算,设氧气消耗物质的量为y,
2SO2(g)+O2(g)?2SO3
起始量(mol) 2a a 0
变化量(mol) 2y y 2y
平衡量(mol)2a-2y a-y 2y
B点气体物质的量为 0.007,则$\frac{2a-2y+a-y+2y}{2a+a}$=$\frac{0.07}{0.1}$,y=0.9a,
平衡常数K=($\frac{(0.007×\frac{1.8}{0.2a+0.1a+1.8a})^{2}}{(0.007×\frac{0.2a}{0.2a+0.1a+1.8a})^{2}×\frac{0.1a}{0.2a+0.1a+1.8a}}$=24300(MPa)-1,
故答案为:24300(MPa)-1 .
点评 本题考查了化学平衡、化学反应速率影响因素的分析应用,图象变化和平衡常数数计算是解题关键,题目难度中等.

 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案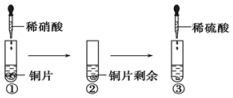
| A. | ①中溶液呈蓝色,试管口有红棕色气体产生,稀硝酸被还原为NO2 | |
| B. | ②中溶液存在:c(Cu2+)+c(H+)=c(NO3-)+c(OH-) | |
| C. | 由上述实验得出结论:常温下,Cu既可与稀硝酸反应,也可与稀硫酸反应 | |
| D. | ③中反应的化学方程式:3Cu+Cu(NO3)2+4H2SO4═4CuSO4+2NO↑+4H2O |
| 族 周期 | I A | II A | III A | IV A | V A | VI A | VII A | 0 |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
(2)地壳中含量最多的元素是氧(填名称);
(3)单质常用作半导体材料的是Si;
(4)Mg原子结构示意图为
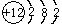 ;
;(5)O和S中,原子半径较大的是S;
(6)CH4和NH3中,热稳定性较强的是NH3(或氨气);
(7)新制氯水有漂白作用,是因为其中含有HClO(填“HCl”或“HCIO”);
(8)元素最高价氧化物对应水化物中,碱性最强的是NaOH(填化学式),两性氢氧化物是 Al(OH)3(填化学式);
(9)某烃分子中含有6个碳原子,结构简式为
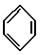 ,常用作有机溶剂.该有机物分子式为 C6H6 ,其中碳元素与氢元素的质量比m(C):m(H)=12:1(相对原子质量:H-1 C-12)
,常用作有机溶剂.该有机物分子式为 C6H6 ,其中碳元素与氢元素的质量比m(C):m(H)=12:1(相对原子质量:H-1 C-12) | A. | Fe2+ | B. | HCO3- | C. | OH- | D. | NH4+ |
| A. | 产生氯气1.792L | B. | 生成AgCl沉淀11.7g | ||
| C. | 被还原的HCl为0.16mol | D. | 转移的电子数为0.16个 |
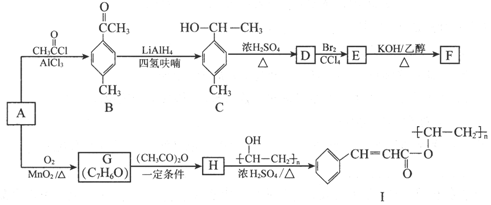
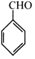
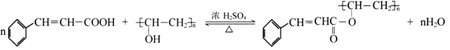
 (写出其中一种的结构简式).
(写出其中一种的结构简式).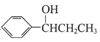 的合成路线
的合成路线 .
.