题目内容
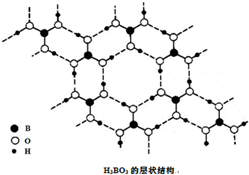 正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子通过氢键相连(如图).下列有关说法正确的是( )
正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子通过氢键相连(如图).下列有关说法正确的是( )| A、正硼酸晶体中只存在氢键 |
| B、H3BO3分子的稳定性与氢键有关 |
| C、分子中硼原子最外层为8电子稳定结构 |
| D、含1molH3BO3的晶体中有3mol氢键 |
考点:晶胞的计算
专题:化学键与晶体结构
分析:A.正硼酸晶体中存在H3BO3分子,根据晶体中存在的微粒间作用力判断;
B.分子的稳定性与化学键有关;
C.硼原子最外层只有3个电子,与氧原子形成3对共用电子对,因此B原子不是8e-稳定结构;
D.利用均摊法计算含1molH3BO3的晶体中的氢键.
B.分子的稳定性与化学键有关;
C.硼原子最外层只有3个电子,与氧原子形成3对共用电子对,因此B原子不是8e-稳定结构;
D.利用均摊法计算含1molH3BO3的晶体中的氢键.
解答:
解:A.正硼酸晶体中存在H3BO3分子,且该晶体中存在氢键,说明硼酸由分子构成,是分子晶体,分子晶体内只有共价键,故A错误;
B.分子的稳定性与分子内的B-O、H-O共价键有关,熔沸点与氢键有关,故B错误;
C.硼原子最外层只有3个电子,与氧原子形成3对共用电子对,因此B原子不是8e-稳定结构,故C错误;
D.1个硼酸分子形成了6个氢键,但每个氢键是2个硼酸分子共用的,所以平均含3个氢键,则含有1molH3BO3的晶体中有3mol氢键,故D正确;
故选D.
B.分子的稳定性与分子内的B-O、H-O共价键有关,熔沸点与氢键有关,故B错误;
C.硼原子最外层只有3个电子,与氧原子形成3对共用电子对,因此B原子不是8e-稳定结构,故C错误;
D.1个硼酸分子形成了6个氢键,但每个氢键是2个硼酸分子共用的,所以平均含3个氢键,则含有1molH3BO3的晶体中有3mol氢键,故D正确;
故选D.
点评:本题考查了晶体类型的判断、影响分子稳定性的因素、原子的杂化方式等知识点,难度不大,注意分子的稳定性与化学键有关,物质的熔沸点与氢键有关.

练习册系列答案
相关题目
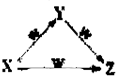 X、Y、Z、W四种物质之间有如图所示的转化关系(部分物质未写全),则X、Y可能是( )
X、Y、Z、W四种物质之间有如图所示的转化关系(部分物质未写全),则X、Y可能是( )①C、CO ②AlCl2、Al(OH)3 ③Fe、Fe(NO3)2 ④NaCO3、NaHCO3.
| A、①②③④ | B、①②④ |
| C、③④ | D、①②③ |
下列实验操作正确的是( )
| A、取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 |
| B、将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道 |
| C、制取NaCl晶体时,将蒸发皿中NaCl溶液全部加热蒸干 |
| D、用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,冷却至室温才能转移到容量瓶中 |
某化合物6.4g在氧气中完全燃烧,只生成8.8g CO2和7.2g H2O.下列说法正确的是( )
| A、该化合物仅含碳、氢两种元素 |
| B、该化合物中碳、氢原子个数比为1:4 |
| C、无法确定该化合物是否含有氧元素 |
| D、该化合物中一定不含有氧元素 |
下列溶液中,在相同的条件下导电能力最强的是( )
| A、50mL1mol/LAlCl3 |
| B、500mL0.3mol/LFeCl3 |
| C、1.0L4mol/LNaCl |
| D、200mL3mol/LMgCl2 |
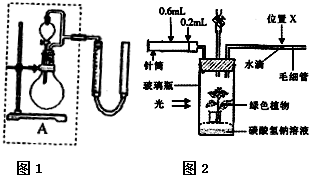 实验1、2研究的目的是
实验1、2研究的目的是