题目内容
作为高中生,学会利用我们课堂上学到的知识来解决生活中的一些问题,是我们学习的重要目的之一.马会五中某化学实验兴趣小组,一行四人,利用实验室老师提供的基本仪器和药品,自行购置了鸡蛋,食醋等生活用品,进行了如下探究.
I.甲同学老家在山西,对儿时在家乡品尝到的山西老陈醋的滋味记忆犹新,跟随父母来到德阳后,总是觉得超市买到的醋不如儿时的味道,查阅相关资料后,得知以下信息:
①醋分两种,酿造醋和配制醋.正宗的老陈醋必须经长久时间酿造才得此美味,市场上多充斥着工业醋酸加水勾兑的配制醋.
②酿造醋国家标准为醋酸含量必须大于3.50g/100mL,而配制醋国家标准仅为1.50g~a3.50g/100mL.
③乙同学在老师的帮助下,测定了超市购买的食醋中,醋酸的物质的量浓度为0.7mol/L.
(1)请帮助乙同学计算从超市购买的食醋中醋酸属于 醋(填“酿造”或“配制”).(提示:醋酸摩尔质量为60g/mol)
(2)请写出醋酸与鸡蛋壳(主要成分为CaCO3)反应的离子方程式 .
Ⅱ.丙同学对课堂上学到的胶体的相关知识产生了浓厚兴趣.
(1)他利用买来的鸡蛋的蛋清配制成溶液,用激光笔照射溶液,发现一条光束穿过鸡蛋清溶液,此现象称为 .
(2)他将乙同学配制好的盐酸溶液加入到鸡蛋清溶液中,发现出现絮状沉淀,此现象称为 .
I.甲同学老家在山西,对儿时在家乡品尝到的山西老陈醋的滋味记忆犹新,跟随父母来到德阳后,总是觉得超市买到的醋不如儿时的味道,查阅相关资料后,得知以下信息:
①醋分两种,酿造醋和配制醋.正宗的老陈醋必须经长久时间酿造才得此美味,市场上多充斥着工业醋酸加水勾兑的配制醋.
②酿造醋国家标准为醋酸含量必须大于3.50g/100mL,而配制醋国家标准仅为1.50g~a3.50g/100mL.
③乙同学在老师的帮助下,测定了超市购买的食醋中,醋酸的物质的量浓度为0.7mol/L.
(1)请帮助乙同学计算从超市购买的食醋中醋酸属于
(2)请写出醋酸与鸡蛋壳(主要成分为CaCO3)反应的离子方程式
Ⅱ.丙同学对课堂上学到的胶体的相关知识产生了浓厚兴趣.
(1)他利用买来的鸡蛋的蛋清配制成溶液,用激光笔照射溶液,发现一条光束穿过鸡蛋清溶液,此现象称为
(2)他将乙同学配制好的盐酸溶液加入到鸡蛋清溶液中,发现出现絮状沉淀,此现象称为
考点:乙酸的化学性质,胶体的重要性质
专题:
分析:I.(1)食醋的物质的量浓度为0.7mol?L-1,总酸量为0.7mol?L-1×60g/mol=44g/L;
(2)醋酸与碳酸钙反应生成醋酸钙、水和二氧化碳;
II.(1)溶液中通过一束光线没有特殊现象,胶体中通过一束光线出现光亮光路,为丁达尔现象;
(2)胶体遇电解质溶液发生聚沉.
(2)醋酸与碳酸钙反应生成醋酸钙、水和二氧化碳;
II.(1)溶液中通过一束光线没有特殊现象,胶体中通过一束光线出现光亮光路,为丁达尔现象;
(2)胶体遇电解质溶液发生聚沉.
解答:
解:I.(1)食醋的物质的量浓度为0.7mol?L-1,总酸量为0.7mol?L-1×60g/mol=44g/L,即4.2g/100mL,为酿造醋,故答案为:酿造;
(2)醋酸与碳酸钙反应生成醋酸钙、水和二氧化碳,离子方程式:2CH3COOH+CaCO3=2CH3COO-+CO2↑+H2O+Ca2+,故答案为:2CH3COOH+CaCO3=2CH3COO-+CO2↑+H2O+Ca2+;
II(1)鸡蛋清溶液是胶体,有丁达尔效应,故答案为:丁达尔效应;
(2)盐酸溶液是电解质溶液,胶体遇电解质溶液发生聚沉,故答案为:胶体聚沉.
(2)醋酸与碳酸钙反应生成醋酸钙、水和二氧化碳,离子方程式:2CH3COOH+CaCO3=2CH3COO-+CO2↑+H2O+Ca2+,故答案为:2CH3COOH+CaCO3=2CH3COO-+CO2↑+H2O+Ca2+;
II(1)鸡蛋清溶液是胶体,有丁达尔效应,故答案为:丁达尔效应;
(2)盐酸溶液是电解质溶液,胶体遇电解质溶液发生聚沉,故答案为:胶体聚沉.
点评:本题考查乙酸的化学性质和胶体的性质,为高频考点,难度较小,旨在考查学生对基础知识的识记,注意基础知识的积累掌握.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
反应4NH3+5O2?4NO+6H2O在一定体积的密闭容器中进行,30s后NO的物质的量浓度增加了3mol/L,则下列反应速率正确的是( )
| A、v (NO)=0.02 mol?(L?s)-1 |
| B、v (NO)=0.2mol?(L?s)-1 |
| C、v (NH3)=0.01 mol?(L?s)-1 |
| D、v (NH3)=0.1 mol?(L?s)-1 |
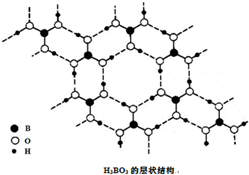 正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子通过氢键相连(如图).下列有关说法正确的是( )
正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子通过氢键相连(如图).下列有关说法正确的是( )| A、正硼酸晶体中只存在氢键 |
| B、H3BO3分子的稳定性与氢键有关 |
| C、分子中硼原子最外层为8电子稳定结构 |
| D、含1molH3BO3的晶体中有3mol氢键 |
除去下列物质中的杂质(括号内是杂质)所用试剂不正确的是( )
| A、NaOH溶液[Ba(OH)2]:用Na2SO4溶液 |
| B、CuO粉末[Fe粉]:用稀盐酸 |
| C、Mg粉[Al粉]:用NaOH溶液 |
| D、HNO3溶液[HCl]:用AgNO3溶液 |
下列食物属于酸性食物的是( )
| A、鸡蛋 | B、苹果 | C、葡萄 | D、西红柿 |
要鉴别己烯中是否混有少量甲苯,正确的实验方法是( )
| A、点燃这种液体,然后观察火焰的颜色 |
| B、先加足量酸性高锰酸钾溶液,然后再加入溴水 |
| C、加入浓硫酸与浓硝酸后加热 |
| D、先加足量溴水,然后再加入酸性高锰酸钾溶液 |
关于丙烯醇(CH2=CH-CH2OH)的叙述不正确的是( )
| A、可使酸性高锰酸钾褪色,反应类型为氧化反应 |
| B、一定条件下可与氢气反应生成丙醇,反应类型为加成反应 |
| C、一定条件下能与乙酸反应生成酯,反应类型为酯化反应 |
| D、该物质与乙醇属于同系物 |
下列有关金属钠的说法中,错误的是( )
| A、钠只有在加热条件下才能与氯气反应 |
| B、钠与氧气反应的产物与反应条件有关 |
| C、工业上通过电解熔融NaCl制备金属钠 |
| D、实验室常将钠保存在煤油中 |
设C+CO2?2CO△H>0(吸热反应)反应速率为 v1,N2+3H2?2NH3△H<0 (放热反应)反应速率为 v2,对于上述反应,当温度升高时,v1和v2的变化情况为( )
| A、都增大 |
| B、都减小 |
| C、?v1增大,?v2减小 |
| D、?v1减小,?v2增大 |