题目内容
下列溶液中,在相同的条件下导电能力最强的是( )
| A、50mL1mol/LAlCl3 |
| B、500mL0.3mol/LFeCl3 |
| C、1.0L4mol/LNaCl |
| D、200mL3mol/LMgCl2 |
考点:电解质溶液的导电性
专题:
分析:溶液的导电能力与溶液中离子浓度和所带电荷有关,根据各个选项中的离子浓度和所带电荷浓度的大小来回答,离子所带电荷浓度越大,导电能力最强.
解答:
解:A、50mL1mol/LAlCl3 溶液中离子浓度共4mol/L;
B、500mL0.3mol/LFeCl3溶液中离子浓度共1.2mol/L;
C、1.0L 4mol/LNaCl溶液中离子浓度共8mol/L;
D、200mL3mol/LMgCl2溶液中离子浓度共9mol/L;
故选D.
B、500mL0.3mol/LFeCl3溶液中离子浓度共1.2mol/L;
C、1.0L 4mol/LNaCl溶液中离子浓度共8mol/L;
D、200mL3mol/LMgCl2溶液中离子浓度共9mol/L;
故选D.
点评:本题考查了溶液的导电能力与溶液中离子浓度和所带电荷有关,分析好各物质中离子所带电荷多少是解题的关键,难度不大.

练习册系列答案
相关题目
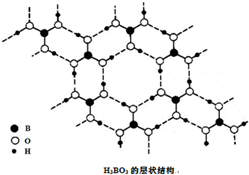 正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子通过氢键相连(如图).下列有关说法正确的是( )
正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子通过氢键相连(如图).下列有关说法正确的是( )| A、正硼酸晶体中只存在氢键 |
| B、H3BO3分子的稳定性与氢键有关 |
| C、分子中硼原子最外层为8电子稳定结构 |
| D、含1molH3BO3的晶体中有3mol氢键 |
关于丙烯醇(CH2=CH-CH2OH)的叙述不正确的是( )
| A、可使酸性高锰酸钾褪色,反应类型为氧化反应 |
| B、一定条件下可与氢气反应生成丙醇,反应类型为加成反应 |
| C、一定条件下能与乙酸反应生成酯,反应类型为酯化反应 |
| D、该物质与乙醇属于同系物 |
下列有关金属钠的说法中,错误的是( )
| A、钠只有在加热条件下才能与氯气反应 |
| B、钠与氧气反应的产物与反应条件有关 |
| C、工业上通过电解熔融NaCl制备金属钠 |
| D、实验室常将钠保存在煤油中 |
在下列各微粒中,能使水的电离平衡向电离方向移动,且使溶液的pH<7的是( )
A、 |
| B、HCO3- |
| C、HSO4- |
D、 |
难挥发性二硫化钽(TaS2)可采用如图装置提纯.将不纯的TaS2粉末装入石英管一端,抽真空后加入适量碘并封管,置于加热炉中,发生反应:TaS2(s)+2I2(g)
TaI4(g)+S2(g).下列说法正确的是( )
| 1123K |
| 1023K |

| A、在不同温度区域,TaI4的量保持不变 |
| B、在提纯过程中,I2的量不断减少 |
| C、该反应的平衡常数与TaI4和S2的浓度乘积成反比 |
| D、在提纯过程中,I2的作用是将TaS2从高温区转移到低温区 |
在密闭容器中,在一定条件下,进行下列反应:NO(g)+CO(g)?
N2(g)+CO2(g);△H=-373.2kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
| 1 |
| 2 |
| A、升高温度 |
| B、增大压强 |
| C、充入N2 |
| D、降低温度 |
设C+CO2?2CO△H>0(吸热反应)反应速率为 v1,N2+3H2?2NH3△H<0 (放热反应)反应速率为 v2,对于上述反应,当温度升高时,v1和v2的变化情况为( )
| A、都增大 |
| B、都减小 |
| C、?v1增大,?v2减小 |
| D、?v1减小,?v2增大 |