题目内容
已知氧化性Br2>Fe3+.FeBr2溶液中通入一定量的Cl2,发生反应的离子方程式为:aFe2++bBr-+cCl2═dFe3++eBr2+fCl-下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是( )
| A、2 6 4 2 3 8 |
| B、2 4 3 2 2 6 |
| C、2 0 1 2 0 2 |
| D、2 2 2 2 1 4 |
考点:氧化还原反应方程式的配平
专题:氧化还原反应专题
分析:向FeBr2溶液中通入氯气,氯气先和亚铁离子发生反应,然后再和溴离子发生反应,根据氯气和FeBr2反应的离子方程式确定a、b、c、d、e、f是否符合反应实际,
A、2Fe2++6Br-+4Cl2→2Fe3++3Br2+8Cl-,氧化性Br2>Fe3+,不可能;
B、2Fe2++4Br-+3Cl2→2Fe3++2Br2+6Cl-,氯气足量时可以发生;
C、2Fe2++0Br-+Cl2→2Fe3++0Br2+2Cl-,氯气不足时,可以发生;
D、2Fe2++2Br-+2Cl2→2Fe3++1Br2+4Cl-,氯气不足,把亚铁离子氧化成三价铁离子后,再部分氧化溴离子.
A、2Fe2++6Br-+4Cl2→2Fe3++3Br2+8Cl-,氧化性Br2>Fe3+,不可能;
B、2Fe2++4Br-+3Cl2→2Fe3++2Br2+6Cl-,氯气足量时可以发生;
C、2Fe2++0Br-+Cl2→2Fe3++0Br2+2Cl-,氯气不足时,可以发生;
D、2Fe2++2Br-+2Cl2→2Fe3++1Br2+4Cl-,氯气不足,把亚铁离子氧化成三价铁离子后,再部分氧化溴离子.
解答:
解:向FeBr2溶液中通入氯气,氯气先和亚铁离子发生反应,然后再和溴离子发生反应,
A、氧化性Br2>Fe3+,不可能存在Fe2+、Br2共存,故A错误;
B、氯气过量,Br-、Fe2+都完全被完全氧化,反应方程式为2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-,故B正确;
C、加入的氯气的物质的量与铁的物质的量1:2时,发生反应 2Fe2+-+Cl2═2Fe3++2Cl-,故C正确;
D、当加入的氯气把Fe2+完全氧化成Fe3+,还有部分剩余时,可以发生反应2Fe2++2Br-+2Cl2→2Fe3++1Br2+4Cl-,故D正确;
故选:A.
A、氧化性Br2>Fe3+,不可能存在Fe2+、Br2共存,故A错误;
B、氯气过量,Br-、Fe2+都完全被完全氧化,反应方程式为2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-,故B正确;
C、加入的氯气的物质的量与铁的物质的量1:2时,发生反应 2Fe2+-+Cl2═2Fe3++2Cl-,故C正确;
D、当加入的氯气把Fe2+完全氧化成Fe3+,还有部分剩余时,可以发生反应2Fe2++2Br-+2Cl2→2Fe3++1Br2+4Cl-,故D正确;
故选:A.
点评:本题以氯气和碘化亚铁的反应为载体考查了氧化还原反应,明确溶液中离子反应的先后顺序是解本题的关键,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
铜粉放入稀硫酸溶液中,加热后无明显变化,但加入下列某试剂一段时间后,发现铜粉质量减少,溶液呈蓝色.加入试剂:①FeCl2;②Na2CO3;③KNO3;④FeSO4;⑤FeCl3;⑥H2O2;⑦NaClO;⑧NaOH.则该试剂可能是( )
| A、①④⑤ | B、②③⑦⑧ |
| C、③⑤⑥⑦ | D、全部 |
将体积为1mL,浓度为0.5mol/L的乙酸和体积为2mL,浓度为0.25mol/L的NaOH溶液混和,所得溶液中离子浓度由大到小的顺序是( )
| A、c(Na+)>c(CH3COO-)>c (OH-)>c(H+) |
| B、c(Na+)=c(CH3COO-),c(CH3COO-)>c (OH-)>c(H+) |
| C、c(Na+)>c (OH-)>c(CH3COO-)>c(H+) |
| D、c(Na+)>c (OH-)>c(H+)>c(CH3COO-) |
下列说法中正确的是( )
| A、标准状况下,22.4L水中所含的分子数约为6.02×1023 | ||
B、标准状况下,aL的氧气和氮气的混合物中含有的分子数约为
| ||
| C、常温常压下,含NA个O3分子的气体的物质的量小于1 mol | ||
| D、28gCO与16gO2的体积比为1:1 |
下列有关实验中,用所选用试剂(括号内物质)不能达到目的是( )
| A、证明FeCl2溶液被氧化(KSCN溶液) |
| B、除去C2H2中的H2S气体(CuSO4溶液) |
| C、鉴别SO2和CO2两种气体(溴水) |
| D、检验Na2SO4溶液中是否混有NaCl(AgNO3溶液) |
现有四种试剂:①新制氢氧化铜悬浊液;②浓硝酸;③硝酸银溶液;④碘水.为了鉴别葡萄糖、淀粉、食盐、鸡蛋清(主要成分是蛋白质)四瓶无色溶液,分别选择合适的试剂,正确的答案是( )
| A、①②③④ | B、④①②③ |
| C、①④②③ | D、①④③② |
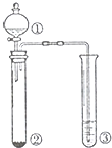
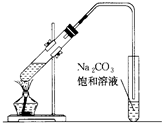 如图是实验室制乙酸乙酯的装置.
如图是实验室制乙酸乙酯的装置.