题目内容
4.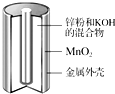 碱性锌锰干电池是生活中应用最普遍的电池之一,其结构如图所示,已知电池放电后的产物是Zn(OH)2和MnOOH.
碱性锌锰干电池是生活中应用最普遍的电池之一,其结构如图所示,已知电池放电后的产物是Zn(OH)2和MnOOH.(1)该电池的负极材料是Zn,正极反应式为MnO2+H2O+e-═MnOOH+OH-;
(2)锌能和KOH发生反应,类似于铝与KOH的反应,其化学方程式为Zn+2KOH=K2ZnO2+H2↑;
(3)用该电池作电源,以硫酸铜溶液为电解液,模拟电解精炼铜.
①精炼铜时,粗铜连接电源的正(填“正”或“负”)极;电解一段时间后,CuSO4溶液的浓度减小(填“增大”、“减小”或“不变”);
②若阴极质量增重32g,则电池消耗MnO2的质量为87g.
分析 (1)原电池中Zn转化为Zn(OH)2,Zn化合价升高,失电子,做负极,正极上发生得电子的还原反应;
(2)金属锌和氢氧化钾之间反应生成偏锌酸钾和氢气;
(3)利用电解法进行粗铜提纯时,粗铜应作阳极,精铜作阴极.阳极与电池的正极相连发生氧化反应,依次是Zn、Fe、Cu放电,阴极与电池的负极相连发生还原反应Cu2++2e-═Cu,根据电极反应结合电子守恒进行计算.
解答 解:(1)原电池中Zn转化为Zn(OH)2,Zn化合价升高,失电子,做负极,正极上发生得电子的还原反应,电极反应式为:MnO2+H2O+e-═MnOOH+OH-,故答案为:Zn;MnO2+H2O+e-=MnOOH+OH-;
(2)金属锌和氢氧化钾之间反应生成偏锌酸钾和氢气,即Zn+2KOH=K2ZnO2+H2↑,故答案为:Zn+2KOH=K2ZnO2+H2↑;
(3)①利用电解法进行粗铜提纯时,粗铜应作阳极,精铜作阴极,粗铜连接电源的正极,阳极与电池的正极相连发生氧化反应,依次是Zn、Fe、Cu放电,阴极与电池的负极相连发生还原反应:Cu2++2e-═Cu,电解一段时间后,CuSO4溶液的浓度减小,故答案为:正;减小;
②若阴极质量增重32g即0.5mol,根据电极反应:Cu2++2e-═Cu,转移电子是1mol,电池的正极反应:MnO2+H2O+e-═MnOOH+OH-,此时消耗MnO2的物质的量是:1mol,质量是87g,故答案为:87.
点评 本题考查学生原电池的工作原理以及应用知识,注意知识的迁移应用是关键,难度中等.

练习册系列答案
相关题目
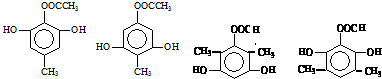
14.分子式为C3H4O2,能与NaOH溶液反应但不能发生加成反应的有机物(不含立体异构)有( )
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
15.原子的核电荷数小于18的某元素X,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数为2n2-1.下列有关X的说法中不正确的是( )
| A. | X能形成化学式为H2XO4的酸 | |
| B. | X能与某些金属元素形成化合物 | |
| C. | X原子的最外层电子数和核电荷数肯定为奇数 | |
| D. | X可能形成化学式为KXO3的盐 |
19.设NA表示阿伏加德罗常数的数值,下列叙述正确的是( )
| A. | 同温同压下,相同体积的氟气和氩气所含的原子数相等 | |
| B. | 标准状况下,1.12 L NO与1.12 L O2的混合物中含有的原子数为0.2NA | |
| C. | 常温下,1L 0.1 mol•L-1 CuSO4溶液中含有的Cu2+数目为0.1NA | |
| D. | 25℃时,1L pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA |
16.锂元素被誉为“能源元素”.锂及锂盐具有的优异性能和特殊功能,在化工、电子、宇航、核能、能源等领域都得到广泛应用.
Ⅰ锂的原子结构示意图为 ;锂暴露在湿空气中时,会迅速地失去金属光泽、表面开始变黑,更长时间则变成白色.生成的化合物是氮化锂、氢氧化锂,最终生成碳酸锂.写出生成氮化锂的化学方程式6Li+N2=2Li3N.
;锂暴露在湿空气中时,会迅速地失去金属光泽、表面开始变黑,更长时间则变成白色.生成的化合物是氮化锂、氢氧化锂,最终生成碳酸锂.写出生成氮化锂的化学方程式6Li+N2=2Li3N.
Ⅱ下面是从锂辉石(Li2O•Al2O3•SiO2)中提出锂的工业流程示意图.
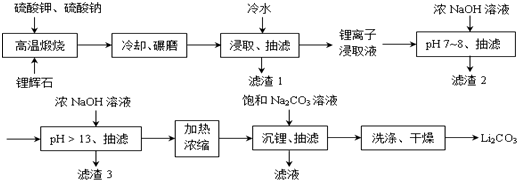
①高温煅烧时的反应原理为:
Li2O•Al2O3•SiO2+K2SO4═K2O•Al2O3•SiO2+Li2SO4
Li2O•Al2O3•SiO2+Na2SO4═Na2O•Al2O3•SiO2+Li2SO4
②锂离子浸取液中含有的金属离子为:K+、Na+、Li+、Fe3+、Fe2+、Al3+、Mn2+.
③几种金属离子沉淀完全的pH
④Li2SO4、Li2CO3在不同温度下的溶解度(g/100g水)
(1)浸取时使用冷水的原因是Li2SO4的溶解度随温度升高而减少,用冷水浸取可以提高浸取率.
(2)滤渣2的主要成分为Al(OH)3、Fe(OH)3.
(3)流程中分2次调节pH(pH7~8和pH>13),有研究者尝试只加一次浓NaOH溶液使pH>13,结果发现在加饱和碳酸钠溶液沉锂后,随着放置时间延长,白色沉淀增加,最后得到的Li2CO3产品中杂质增多.Li2CO3产品中的杂质可能是Al(OH)3,用离子方程式表示其产生的原因Al3++4OH-=AlO2-+2H2O;2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-.
(4)加热浓缩的作用是提高Li+ 浓度和溶液温度,使得Li2CO3容易析出.
(5)洗涤Li2CO3晶体使用热水.
Ⅰ锂的原子结构示意图为
 ;锂暴露在湿空气中时,会迅速地失去金属光泽、表面开始变黑,更长时间则变成白色.生成的化合物是氮化锂、氢氧化锂,最终生成碳酸锂.写出生成氮化锂的化学方程式6Li+N2=2Li3N.
;锂暴露在湿空气中时,会迅速地失去金属光泽、表面开始变黑,更长时间则变成白色.生成的化合物是氮化锂、氢氧化锂,最终生成碳酸锂.写出生成氮化锂的化学方程式6Li+N2=2Li3N.Ⅱ下面是从锂辉石(Li2O•Al2O3•SiO2)中提出锂的工业流程示意图.

①高温煅烧时的反应原理为:
Li2O•Al2O3•SiO2+K2SO4═K2O•Al2O3•SiO2+Li2SO4
Li2O•Al2O3•SiO2+Na2SO4═Na2O•Al2O3•SiO2+Li2SO4
②锂离子浸取液中含有的金属离子为:K+、Na+、Li+、Fe3+、Fe2+、Al3+、Mn2+.
③几种金属离子沉淀完全的pH
| 金属离子 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 |
| 沉淀完全的pH | 4.7 | 9.0 | 3.2 | 10.1 |
| 温度 溶解度 | 10℃ | 20℃ | 50℃ | 80℃ |
| Li2SO4 | 35.4 | 34.7 | 33.1 | 31.7 |
| Li2CO3 | 1.43 | 1.33 | 1.08 | 0.85 |
(2)滤渣2的主要成分为Al(OH)3、Fe(OH)3.
(3)流程中分2次调节pH(pH7~8和pH>13),有研究者尝试只加一次浓NaOH溶液使pH>13,结果发现在加饱和碳酸钠溶液沉锂后,随着放置时间延长,白色沉淀增加,最后得到的Li2CO3产品中杂质增多.Li2CO3产品中的杂质可能是Al(OH)3,用离子方程式表示其产生的原因Al3++4OH-=AlO2-+2H2O;2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-.
(4)加热浓缩的作用是提高Li+ 浓度和溶液温度,使得Li2CO3容易析出.
(5)洗涤Li2CO3晶体使用热水.
13.下列物质与其用途不相符的是( )
| A. | 乙二醇--抗冻剂 | B. | NaCl--制纯碱 | C. | Al2O3--焊接钢轨 | D. | 甲苯--制炸药 |
14.X、Y、Z、R是四种短周期主族元素,X原子最外层电子数是次外层的2倍,Y元素在地壳中含量最多,Z 元素金属性最强,R原子的核外电子数是X、Z核外电子数之和.下列叙述一定正确的是( )
| A. | 含氧酸酸性R>X | B. | 简单氢化物稳定性Y<X | ||
| C. | 最高正化合价Z<X<Y<R | D. | 由Z和R形成的化合物为离子化合物 |
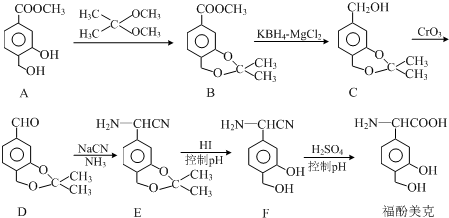
 .
. 任意一种.
任意一种.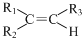 $→_{②Zn/H_{20}}^{①O_{3}}$
$→_{②Zn/H_{20}}^{①O_{3}}$ 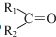 +R3CHO,根据已有知识并结合相关信息,写出以
+R3CHO,根据已有知识并结合相关信息,写出以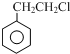 为原料制备
为原料制备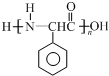 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).