题目内容
12.某元素的同位素X,它的氯化物XCl1.17g溶于水制成溶液后,加入1mol•L-1的AgNO3溶液20mL恰好完全反应.若这种同位素原子核内有12个中子,试通过计算确定:(1)X元素在周期表中的位置;(写出计算过程)
(2)把一小粒X的单质放入水中,有何现象?写出反应的化学方程式.
分析 根据Cl-+Ag+═AgCl↓计算XCl2的物质的量,再由M=$\frac{m}{M}$计算其摩尔质量,摩尔质量与相对分子质量的数值相等,原子的质量数为原子的近似相对原子质量,结合该原子原子核内有12个中子,根据质子数=质量数-中子数来计算原子的质子数,利用质子数确定元素在周期表中的位置,并利用质量守恒定律及X的性质来书写反应方程式,推测现象.
解答 解:(1)由Cl-+Ag+═AgCl↓可知,n(Cl-)=n(Ag+)=0.02L×1mol/L=0.02mol,
n(XCl)=n(Cl-)=0.02mol,则M(XCl)=$\frac{1.17g}{0.02mol}$=58.5g/mol,
所以XCl相对分子质量为58.5,
所以X的相对原子质量=58.5-35.5=23,即X的质量数为23,
质子数=质量数-中子数=23-12=11,
位于第三周期第ⅠA族,答:X位于第三周期第ⅠA族;
(2)钠浮在水面上,四处游动,熔化成一个小球,Na水剧烈反应生成NaOH和H2,放热,有气体放出,该反应为2Na+2H2O═2NaOH+H2↑.
答:钠浮在水面上,四处游动,熔化成一个小球,该反应为2Na+2H2O═2NaOH+H2↑.
点评 本题考查反应方程式的计算、原子结构与元素推断、金属性质等,难度不大,注重对基础知识的理解掌握.

练习册系列答案
相关题目
20.下列互为同位素的是( )
| A. | ${\;}_{1}^{1}$H2、${\;}_{1}^{2}$H2、${\;}_{1}^{3}$H2 | B. | ${\;}_{6}^{12}$C、${\;}_{6}^{14}$C | ||
| C. | D2O、H2O | D. | 金刚石、石墨 |
7.3.2g铜与过量的硝酸(8mol•L-1,60mL)充分反应后,硝酸的还原产物有NO、NO2,反应后溶液中所含H+离子为nmol.此时溶液中所含NO3-的物质的量为( )
| A. | 0.28mol | B. | 0.3lmol | C. | (n+0.2)mol | D. | (n+0.1)mol |
17.下列有关有机化合物的叙述正确的是( )
| A. | 植物油与聚乙烯均能使溴水褪色 | |
| B. | 淀粉与纤维素均为高分子化合物且互为同分异构体 | |
| C. | 蔗糖与麦芽糖的水解产物均为葡萄糖 | |
| D. | 丙烷与2-甲基丙烷的一氯代物均为两种 |
1.对二甲苯( PX )是生产矿泉水瓶(聚对苯二甲酸乙二酯,简称PET)的必要原料,生产涉及的反应之一如下:
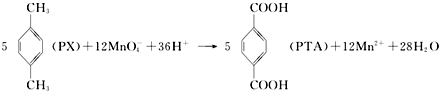
下列有关说法错误的是( )

下列有关说法错误的是( )
| A. | PTA是该反应的氧化产物 | |
| B. | PTA与乙二醇通过加聚反应即可生产PET塑料 | |
| C. | PX分子含有苯环的同分异构体还有3种 | |
| D. | 该反应消耗 1molPX,共转移12NA个电子 (NA为阿伏加德罗常数) |
2.下列说法不正确的是( )
| A. | 在酸性介质中钢铁容易发生析氢腐蚀,随着pH升高发生吸氧腐蚀的几率增大 | |
| B. | 电解水制氢比光催化还原水制氢更节能环保、更经济 | |
| C. | 青蒿素在超临界CO2中有很强的溶解性,萃取青蒿素时可用超临界CO2作萃取剂 | |
| D. | 钙基固硫和NOx的催化转化都是解决空气污染问题的措施 |
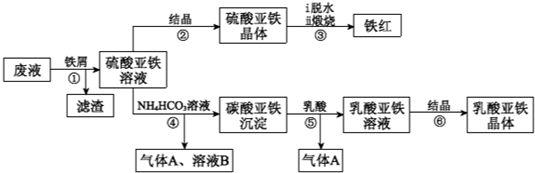

 .
.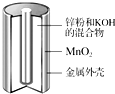 碱性锌锰干电池是生活中应用最普遍的电池之一,其结构如图所示,已知电池放电后的产物是Zn(OH)2和MnOOH.
碱性锌锰干电池是生活中应用最普遍的电池之一,其结构如图所示,已知电池放电后的产物是Zn(OH)2和MnOOH.