题目内容
14.X、Y、Z、R是四种短周期主族元素,X原子最外层电子数是次外层的2倍,Y元素在地壳中含量最多,Z 元素金属性最强,R原子的核外电子数是X、Z核外电子数之和.下列叙述一定正确的是( )| A. | 含氧酸酸性R>X | B. | 简单氢化物稳定性Y<X | ||
| C. | 最高正化合价Z<X<Y<R | D. | 由Z和R形成的化合物为离子化合物 |
分析 X、Y、Z、R是短周期主族元素,X原子最外层电子数是次外层的2倍,原子只能有2个电子层,最外层电子数为4,故X为C;Y元素在地壳中含量最多,则Y为O;Z元素金属性最强,则Z为Na;R原子的核外电子数是X、Z核外电子数之和,R原子核外电子数为6+11=17,故R为Cl.
解答 解:X、Y、Z、R是短周期主族元素,X原子最外层电子数是次外层的2倍,原子只能有2个电子层,最外层电子数为4,故X为C;Y元素在地壳中含量最多,则Y为O;Z元素金属性最强,则Z为Na;R原子的核外电子数是X、Z核外电子数之和,R原子核外电子数为6+11=17,故R为Cl.
A.碳酸的酸性比HClO的酸性强,故A错误;
B.非金属Y(O)>X(C),故氢化物稳定性:水>甲烷,故B错误;
C.氧元素没有最高正化合价,故C错误;
D.由Z和R形成的化合物为氧化钠、过氧化钠,均属于离子化合物,故D正确.
故选:D.
点评 本题考查结构性质位置关系应用,注意对元素周期律与元素化合物结构性质的掌握,A选项学生容易根据最高价含氧酸酸性判断.

练习册系列答案
相关题目
5.高温下,某反应达到平衡,平衡常数K=$\frac{[CO][{H}_{2}O]}{[C{O}_{2}][{H}_{2}]}$,保持其他条件不变,若温度升高,c(H2)减小.对该反应的分析正确的是( )
| A. | 反应的化学方程式为:CO+H2O?CO2+H2 | |
| B. | 升高温度,v(正)、v(逆)都增大,且v(逆)增大更多 | |
| C. | 缩小容器体积,v(正)、v(逆)都增大,且v(正)增大更多 | |
| D. | 升高温度或缩小容器体积,混合气体的平均相对分子量都不会发生改变 |
2.下列说法不正确的是( )
| A. | 在酸性介质中钢铁容易发生析氢腐蚀,随着pH升高发生吸氧腐蚀的几率增大 | |
| B. | 电解水制氢比光催化还原水制氢更节能环保、更经济 | |
| C. | 青蒿素在超临界CO2中有很强的溶解性,萃取青蒿素时可用超临界CO2作萃取剂 | |
| D. | 钙基固硫和NOx的催化转化都是解决空气污染问题的措施 |
6.下列说法不正确的是( )
| A. | 臭氧与空气中的氮氧化合物发生作用后会产生光化学烟雾,对人体健康、植物成长等都有很大危害 | |
| B. | 农业废弃物、城市与工业有机废弃物及动物粪便中都蕴藏着丰富的生物质能 | |
| C. | 分光光度计可用于分析溶液颜色与反应物(或生成物哪个)浓度的关系,从而确定化学反应速率 | |
| D. | 某些铝硅酸盐形成的分子筛中有许多笼状空穴和通道,常用于分离、提纯气体或液体混合物,还可作干燥剂、离子交换剂、催化剂及催化剂载体等 |
3.有机物X的分子数为C6H10O2,在稀硫酸中加热可得到Y、Z两种物质,其中Y能使溴的CCl4溶液褪色,能与NaHCO3溶液反应且分子中只含有一个甲基,则X最多有(不考虑立体异构)( )
| A. | 7种 | B. | 6种 | C. | 5种 | D. | 4种 |
10.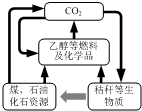 我国《可再生能源法》倡导碳资源的高效转化及循环利用(如图所示).下列做法与上述理念相违背的是( )
我国《可再生能源法》倡导碳资源的高效转化及循环利用(如图所示).下列做法与上述理念相违背的是( )
 我国《可再生能源法》倡导碳资源的高效转化及循环利用(如图所示).下列做法与上述理念相违背的是( )
我国《可再生能源法》倡导碳资源的高效转化及循环利用(如图所示).下列做法与上述理念相违背的是( )| A. | 大力发展煤的气化及液化技术 | B. | 加快石油等化石燃料的开采和使用 | ||
| C. | 以CO2 为原料生产可降解塑料 | D. | 将秸秆进行加工转化为乙醇燃料 |
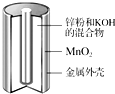 碱性锌锰干电池是生活中应用最普遍的电池之一,其结构如图所示,已知电池放电后的产物是Zn(OH)2和MnOOH.
碱性锌锰干电池是生活中应用最普遍的电池之一,其结构如图所示,已知电池放电后的产物是Zn(OH)2和MnOOH. .
. A、B、C、D、E为原子序数依次增大的五种元素,A的一种同位素可用于考古中测定生物的死亡年代; B与A同周期,其s能级电子数比p能级电子数多;C原子的最外层电子数是次外层的3倍;D与B同主族;E的原子序数为29.回答下列问题:
A、B、C、D、E为原子序数依次增大的五种元素,A的一种同位素可用于考古中测定生物的死亡年代; B与A同周期,其s能级电子数比p能级电子数多;C原子的最外层电子数是次外层的3倍;D与B同主族;E的原子序数为29.回答下列问题: .
.