题目内容
20.把Ba(OH)2溶液滴入明矾(KAl(SO4)2•12H2O)溶液中,使SO42-全部转化成BaSO4沉淀,此时铝元素的主要存在形式是( )| A. | Al3+ | B. | Al(OH)3 | C. | [Al(OH)4]- | D. | Al3+和Al(OH)3 |
分析 明矾的化学式为KAl(SO4)2•12H2O,设明矾为1mol,则溶液中含有1molAl3+,2molSO42-,根据反应:SO42-+Ba2+=BaSO4↓,Al3++4OH-=Al(OH)4-判断.
解答 解:明矾的化学式为KAl(SO4)2•12H2O,设明矾为1mol,则溶液中含有1molAl3+,2molSO42-,由反应SO42-+Ba2+=BaSO4↓可知,使SO42-全部转化成BaSO4沉淀,需要2molBa(OH)2,则加入4molOH-,则发生Al3++4OH-=Al(OH)4-,所以最后溶液中存在[Al(OH)4]-,故选C.
点评 本题考查离子方程式的书写,题目难度中等,本题中注意判断使SO42-全部转化成BaSO4沉淀需要Ba(OH)2的物质的量,根据Al3+和OH-物质的量的关系判断反应产物.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.研究有机物一般经过以下几个基本步骤:分离、提纯→确定实验式→确定分子式→确定结构式,以下用于研究有机物的方法错误的是( )
| A. | 蒸馏常用于分离提纯液态有机混合物 | |
| B. | 核磁共振氢谱通常用于分析有机物中氢的个数 | |
| C. | 对有机物分子红外光谱图的研究有助于确定有机物分子中的官能团 | |
| D. | 燃烧法是研究确定有机物元素组成的有效方法 |
15.几种短周期元素的原子半径及化合价见表:
分析上表中有关数据,结合已学过的知识,回答以下问题.涉及上述元素的答案,请用元素符号表示.
(1)E元素在周期表中的位置是第3周期第ⅥA族.
(2)A、H、J对应的离子半径由大到小的顺序是(填写离子符号)F-、Na+、Al3+.
(3)用电子式表示A与I所形成化合物的形成过程 .
.
(4)B与H所形成的化合物与J的最高价氧化物的水化物X的溶液发生反应的离子方程式为Al2O3+3OH-=2AlO2-+H2O;
(5)用B与D所形成的化合物制备D单质的化学方程式为SiO2+2C$\frac{\underline{\;\;△\;\;}}{\;}$Si+2CO↑.
| 元素代号 | A | B | D | E | G | H | I | J |
| 化合价 | -1 | -2 | +4、-4 | +6、-2 | +5、-3 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.130 | 0.102 | 0.110 | 0.143 | 0.160 | 0.186 |
(1)E元素在周期表中的位置是第3周期第ⅥA族.
(2)A、H、J对应的离子半径由大到小的顺序是(填写离子符号)F-、Na+、Al3+.
(3)用电子式表示A与I所形成化合物的形成过程
 .
.(4)B与H所形成的化合物与J的最高价氧化物的水化物X的溶液发生反应的离子方程式为Al2O3+3OH-=2AlO2-+H2O;
(5)用B与D所形成的化合物制备D单质的化学方程式为SiO2+2C$\frac{\underline{\;\;△\;\;}}{\;}$Si+2CO↑.
12.元素X、Y、Z的原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子排布.下列推测不正确的是( )
| A. | 同族元素中Z的氢化物稳定性最高 | |
| B. | 原子半径:X>Y,离子半径:X+>Z2- | |
| C. | 同周期元素中X的金属性最强 | |
| D. | 同周期元素中Y的最高价含氧酸的酸性最强 |
9.下列有关石油和煤的利用叙述不正确的是( )
| A. | 煤的干馏就是将煤隔绝空气在高温使之分解,得到焦炭、煤焦油等物质的过程 | |
| B. | 煤的液化就是将煤转化成甲醇、乙醇等其液态物质的过程 | |
| C. | 煤的气化就是将煤在高温条件由固态转化为气态的物理变化过程 | |
| D. | 通过催化裂化或裂解,可以获得碳原子数较少的轻质油 |
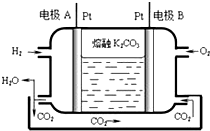 一种新型氢氧燃料电池工作原理如图所示.
一种新型氢氧燃料电池工作原理如图所示.