题目内容
9.①写出离子反应方程式:BaCl2+Na2SO4═BaSO4↓+2NaClBa2++SO42-═BaSO4↓;
②用单线桥法标出电子转移的方向和数目:Fe+2HCl═FeCl2+H2↑
 .
.
分析 ①氯离子、钠离子实际不参加反应,硫酸钡在离子反应中保留化学式;
②Fe+2HCl═FeCl2+H2↑中Fe失去电子,H得到电子,转移2e-.
解答 解:①氯离子、钠离子实际不参加反应,硫酸钡在离子反应中保留化学式,离子反应为Ba2++SO42-═BaSO4↓,
故答案为:Ba2++SO42-═BaSO4↓;
②Fe+2HCl═FeCl2+H2↑中Fe元素化合价由0价变为+2价、H元素化合价由+1价变为0价,所以属于氧化还原反应,转移电子数为2,单线桥表示转移电子方向和数目为 ,
,
故答案为: .
.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电子转移,题目难度不大.

练习册系列答案
相关题目
19.一定温度时,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应:2SO2(g)+O2(g)?2SO3(g)△H=-196kJ•moL-1,一段时间后达平衡,反应过程中测定的部分数据见表:
下列说法不正确的是( )
| 反应时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 2 | 1 |
| 5 | 1.2 | |
| 10 | 0.4 | |
| 15 | 0.8 |
| A. | 反应在前5min的平均速率为v (SO2)=0.08mol•L-1•min-1 | |
| B. | 相同温度下,起始时向容器中充入1.5mol SO3,达平衡时SO3的转化率为40% | |
| C. | 保持温度不变,向平衡后的容器中再充入0.2molSO2和0.2mol SO3时,v (正)>v (逆) | |
| D. | 保持其他条件不变,若起始时向容器中充入2molSO3,达平衡时吸收78.4kJ的热量 |
20.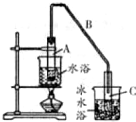 某化学小组以环己醇
某化学小组以环己醇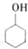 制备环己烯:已知
制备环己烯:已知
(1)制备粗品将12.5mL环已醇加入试管A中,再加入 1ml,浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环已烯粗品.
①写出环已醇制备环已烯的化学反应方程式
②A中碎瓷片的作用是防止暴沸,导管B除了导气外还具有的作用是冷凝.
③试管C置于冰水浴中的目的是冷却,防止环己烯挥发.
(2)环已烯粗品中含有环已醇和少量酸性杂成等.需要提纯.
①加入饱和食盐水,振荡、静置、分层,水在下层(填上或下).分液后用c (填入编号)洗涤.
a.KMnO4溶液 b.稀 H2SO4 c.Na2CO3溶液
②再将环已烯热馏,蒸馏时要加入生石灰,目的是除去环已烯中混有的少量水.
③收集产品时,控制的温度应在83℃左右.
(3)以下区分环已烯精品和粗品的方法,合理的是b.
a.用酸性高锰酸钾溶液b.用金属钠 c.溴水.
 某化学小组以环己醇
某化学小组以环己醇 制备环己烯:已知
制备环己烯:已知| 密度(g/cm3) | 溶点(℃) | 沸点(℃) | 溶解性 | |
| 环已醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环已烯 | 0.81 | -103 | 83 | 难溶于水 |
①写出环已醇制备环已烯的化学反应方程式

②A中碎瓷片的作用是防止暴沸,导管B除了导气外还具有的作用是冷凝.
③试管C置于冰水浴中的目的是冷却,防止环己烯挥发.
(2)环已烯粗品中含有环已醇和少量酸性杂成等.需要提纯.
①加入饱和食盐水,振荡、静置、分层,水在下层(填上或下).分液后用c (填入编号)洗涤.
a.KMnO4溶液 b.稀 H2SO4 c.Na2CO3溶液
②再将环已烯热馏,蒸馏时要加入生石灰,目的是除去环已烯中混有的少量水.
③收集产品时,控制的温度应在83℃左右.
(3)以下区分环已烯精品和粗品的方法,合理的是b.
a.用酸性高锰酸钾溶液b.用金属钠 c.溴水.
17.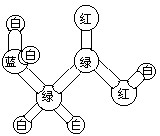 如图是某分子的球棍模型图.图中“棍”代表单键、双键或三键.不同颜色的球代表不问元素的原子,该模型图可代表一种( )
如图是某分子的球棍模型图.图中“棍”代表单键、双键或三键.不同颜色的球代表不问元素的原子,该模型图可代表一种( )
 如图是某分子的球棍模型图.图中“棍”代表单键、双键或三键.不同颜色的球代表不问元素的原子,该模型图可代表一种( )
如图是某分子的球棍模型图.图中“棍”代表单键、双键或三键.不同颜色的球代表不问元素的原子,该模型图可代表一种( )| A. | 卤代羧酸 | B. | 酯 | C. | 氨基酸 | D. | 醇 |
4.以下电离方程式错误的是( )
| A. | NaHCO3=Na++H++CO32- | B. | Fe2(SO4)3=2Fe3++3SO42- | ||
| C. | MgCl2=Mg2++2Cl- | D. | NaOH=Na++OH- |
14.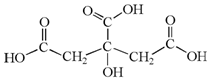 柠檬中含有的柠檬酸(其结构简式如下)对鲜切苹果具有较好的保鲜效果,可以在一段时间内防止鲜切苹果表面变色.下列说法不正确的是( )
柠檬中含有的柠檬酸(其结构简式如下)对鲜切苹果具有较好的保鲜效果,可以在一段时间内防止鲜切苹果表面变色.下列说法不正确的是( )
 柠檬中含有的柠檬酸(其结构简式如下)对鲜切苹果具有较好的保鲜效果,可以在一段时间内防止鲜切苹果表面变色.下列说法不正确的是( )
柠檬中含有的柠檬酸(其结构简式如下)对鲜切苹果具有较好的保鲜效果,可以在一段时间内防止鲜切苹果表面变色.下列说法不正确的是( )| A. | 柠檬酸的分子式是C6H8O7 | B. | 柠檬酸是易溶于水的有机物 | ||
| C. | 柠檬酸分子中含有羧基和羟基 | D. | 柠檬酸只能发生取代反应 |
1.某研究性学习小组为了研究影响化学反应速率的因素,设计如下方案:
已知:反应的方程式(未配平):KMnO4+H2C2O4+H2SO4→K2SO4+MnSO4+CO2↑+H2O
(1)实验记时方法是从溶液混合开始记时,至紫红色刚好褪去时记时结束.
(2)实验I和Ⅱ研究浓度对反应速率的影响,实验Ⅰ和Ⅲ研究温度对反应速率的影响.则v2=1,v3=2,v5=0.
(3)请配平上面的化学方程式:
2KMnO4+5H2C2O4+3H2SO4=1K2SO4+2MnSO4+10CO2↑+8H2O.
(4)某小组在进行每组实验时,均发现该反应所示开始很慢,突然就加快,其可能的原因是MnSO4是反应产物,开始浓度小,影响不大,随着反应进行,浓度增大,催化效果明显.
(5)实验结束后,读数前为了使两个量气管的压强相等,避免产生压强差,影响测定结果,需要进行的操作是移动量气管,使两个量气管的液面相平.
| 实验 编号 | 0.01mol•L-1 酸性KMnO4溶液 | 0.1mol•L-1 H2C2O4溶液 | 水 | 1mol•L-1 MnSO4溶液 | 反应温度 /℃ | 反应时间 |
| Ⅰ | 2mL | 2mL | 0 | 0 | 20 | 125 |
| Ⅱ | v1mL | v2mL | 1mL | 0 | 20 | 320 |
| Ⅲ | v3mL | v4mL | v5mL | 0 | 50 | 30 |
| Ⅳ | 2mL | 2mL | 0 | 2滴 | 20 | 10 |
(1)实验记时方法是从溶液混合开始记时,至紫红色刚好褪去时记时结束.
(2)实验I和Ⅱ研究浓度对反应速率的影响,实验Ⅰ和Ⅲ研究温度对反应速率的影响.则v2=1,v3=2,v5=0.
(3)请配平上面的化学方程式:
2KMnO4+5H2C2O4+3H2SO4=1K2SO4+2MnSO4+10CO2↑+8H2O.
(4)某小组在进行每组实验时,均发现该反应所示开始很慢,突然就加快,其可能的原因是MnSO4是反应产物,开始浓度小,影响不大,随着反应进行,浓度增大,催化效果明显.
(5)实验结束后,读数前为了使两个量气管的压强相等,避免产生压强差,影响测定结果,需要进行的操作是移动量气管,使两个量气管的液面相平.
18.下列实验对应的现象及结论均正确且两者具有因果关系的选项是( )
| 选项 | 实验 | 现象 | 结论 |
| A | SO2通入BaCl2溶液,然后滴入稀硝酸 | 有白色沉淀,白色沉淀不溶于稀硝酸 | 所得沉淀为BaSO3,后转化为BaSO4 |
| B | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 | 熔化后的液态铝滴落下来 | 金属铝的熔点较低 |
| C | 将稀硫酸滴入碳酸钠溶液中产生的气体通入硅酸钠溶液 | 有白色沉淀生成 | 证明非金属性S>C>Si |
| D | 向含有淀粉的FeI2溶液中滴加足量的氯水 | 溶液变蓝 | 还原性:I->Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
9.环己酮是一种重要的有机化工原料.实验室合成环己酮的反应如下:
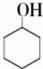 $→_{Na_{2}Cr_{2}O_{7}+H_{2}SO_{4}}^{55℃~69℃}$
$→_{Na_{2}Cr_{2}O_{7}+H_{2}SO_{4}}^{55℃~69℃}$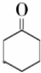
环己醇和环己酮的部分物理性质见下表:
现以20mL环己醇与足量Na2Cr2O7和硫酸的混合液充分反应,制得主要含环己酮和水的粗产品,然后进行分离提纯.
分离提纯过程中涉及到的主要步骤有(未排序):
a.蒸馏,除去乙醚后,收集151℃~156℃馏分;
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层;
c.过滤;
d.往液体中加入NaCl固体至饱和,静置,分液;
e.加入无水MgSO4固体,除去有机物中少量水.
回答下列问题:
(1)上述分离提纯步骤的正确顺序是d b e c a(填字母).
(2)b中水层用乙醚萃取的目的是使水层中少量的有机物进一步被提取,提高产品的产量.
(3)以下关于萃取分液操作的叙述中,正确的是③.
①振荡几次后需打开分液漏斗上口的玻璃塞放气
②经几次振荡并放气后,手持分液漏斗静置待液体分层
③分液时,需先将上口玻璃塞打开或玻璃塞上的凹槽对准漏斗口上的小孔,再打开旋塞待下层液体全部流尽时,再从上口倒出上层液体
(4)在上述操作d中,加入NaCl固体的作用是降低环己酮的溶解度,增加水层的密度,有利于分层.蒸馏除乙醚的操作中采用的加热方式为水浴加热.
(5)蒸馏操作时,一段时间后发现未通冷凝水,应采取的正确方法是停止加热,冷却后通自来水.
(6)恢复至室温时,分离得到纯产品体积为 12mL,则环己酮的产率约是60%.
 $→_{Na_{2}Cr_{2}O_{7}+H_{2}SO_{4}}^{55℃~69℃}$
$→_{Na_{2}Cr_{2}O_{7}+H_{2}SO_{4}}^{55℃~69℃}$
环己醇和环己酮的部分物理性质见下表:
| 物质 | 相对分子质量 | 沸点(℃) | 密度(g•cm-3,20℃) | 溶解性 |
| 环己醇 | 100 | 161.1 | 0.9624 | 能溶于水和醚 |
| 环己酮 | 98 | 155.6 | 0.9478 | 微溶于水,能溶于醚 |
分离提纯过程中涉及到的主要步骤有(未排序):
a.蒸馏,除去乙醚后,收集151℃~156℃馏分;
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层;
c.过滤;
d.往液体中加入NaCl固体至饱和,静置,分液;
e.加入无水MgSO4固体,除去有机物中少量水.
回答下列问题:
(1)上述分离提纯步骤的正确顺序是d b e c a(填字母).
(2)b中水层用乙醚萃取的目的是使水层中少量的有机物进一步被提取,提高产品的产量.
(3)以下关于萃取分液操作的叙述中,正确的是③.
①振荡几次后需打开分液漏斗上口的玻璃塞放气
②经几次振荡并放气后,手持分液漏斗静置待液体分层
③分液时,需先将上口玻璃塞打开或玻璃塞上的凹槽对准漏斗口上的小孔,再打开旋塞待下层液体全部流尽时,再从上口倒出上层液体
(4)在上述操作d中,加入NaCl固体的作用是降低环己酮的溶解度,增加水层的密度,有利于分层.蒸馏除乙醚的操作中采用的加热方式为水浴加热.
(5)蒸馏操作时,一段时间后发现未通冷凝水,应采取的正确方法是停止加热,冷却后通自来水.
(6)恢复至室温时,分离得到纯产品体积为 12mL,则环己酮的产率约是60%.