题目内容
8.已知:硝酸铜受热易分解.170℃时,2Cu (NO3)2$\stackrel{△}{→}$2CuO+4NO2↑+O2↑开始分解,至250℃分解完全.(其中2NO2?N2O4,2NO2→2NO+O2等反应忽略不计).
800℃时,4CuO$\stackrel{高温}{→}$2Cu2O+O2↑ 开始分解,至1000℃以上分解完全.
(1)取5.64g无水硝酸铜,加热至1000℃以上,将生成的气体导入足量的NaOH溶液充分吸收后,还有逸出的气体是O2(填分子式),体积(标准状况)为0.168L;将吸收液加水稀释到100mL,此溶液中NO3-的物质的量浓度为0.6mol/L.
(2)取5.64g无水硝酸铜加热至某温度分解后的残留固体中含有1.60g CuO,则残留固体的质量可能是2.32g或3.48g
实验证明,当温度达到1800℃时,Cu2O也会发生分解:2Cu2O$\stackrel{1800℃}{→}$4Cu+O2↑
(3)取8.00g CuO,加热到1800℃左右,冷却后称得质量为6.88g,通过计算求出反应后剩余固体中各成分的物质的量之比.
(4)取8.00g CuO,通入一定量H2并加热,使其部分还原为Cu和Cu2O,且其中n (Cu2O):n (Cu)=x.将此混合物溶于足量的稀硫酸中(Cu2O+2H+→Cu+Cu2++H2O),充分反应后过滤得到Cu y g,试求未被还原的CuO的物质的量0.1-$\frac{y+2xy}{64(x+1)}$(用含x、y的代数式表示).
分析 (1)无水硝酸铜分解生成CuO时,生成的NO2与O2恰好与水完全反应,多余的气体为CuO分解生成的氧气,根据4CuO~O2计算剩余氧气的物质的量,再根据V=nVm计算体积;根据n=$\frac{m}{M}$计算5.64g无水硝酸铜物质的量,由转化关系可知,5.64g无水硝酸铜中含有的硝酸根等于溶液中含有的硝酸根,再根据c=$\frac{n}{V}$计算;
(2)残留固体可能是CuO和Cu2O的混合物,也可能是CuO和Cu(NO3)2的混合物,据此讨论结合铜原子守恒计算;
(3)根据固体质量减少与氧化铜中含有的氧元素质量,判断氧化铜是否完全发生转化为Cu,进而判断剩余固体中Cu元素、O元素的质量,确定Cu原子与氧原子关系,确定剩余固体的组成,据此计算解答;
(4)过滤得到ygCu来源于氢气还原生成的Cu及Cu2O与酸反应生成的Cu,令氢气还原生成的Cu的物质的量为nmol,则Cu2O的物质的量分别nxmol,根据方程式计算Cu2O与酸反应生成的Cu的物质的量,进而计算n的值,再根据Cu原子守恒计算为分解的Cu.
解答 解:(1)无水硝酸铜分解生成CuO时,生成的NO2与O2恰好与水完全反应,多余的气体为CuO分解生成的氧气,由可知关系式4CuO~O2可知,n(O2)=0.03mol×$\frac{1}{4}$=0.0075(mol),所以标准状况下氧气的体积为0.0075mol×22.4L/mol=0.168 L,
5.64g无水硝酸铜物质的量为$\frac{5.64g}{188g/mol}$=0.03mol,由转化关系可知,5.64g无水硝酸铜中含有的硝酸根等于溶液中含有的硝酸根,故溶液中硝酸根的物质的量为0.03mol×2=0.06mol,故稀释后溶液中硝酸根的物质的量浓度为$\frac{0.06mol}{0.1L}$=0.6mol/L,
故答案为:O2;0.168L;0.6mol/L;
(2)残留固体可能是CuO和Cu2O的混合物,也可能是CuO和Cu(NO3)2的混合物.若为CuO和Cu2O的混合物,则n(CuO)=$\frac{1.6g}{80g/mol}$=0.02 mol,n(CuO)+2n(Cu2O)=0.03 mol,所以n(Cu2O)=0.005 mol,故m(Cu2O)=144g/mol×0.005mol=0.72g,m(残留固体)=1.60 g+0.72 g=2.32 g; 若为CuO和Cu(NO3)2的混合物,则n(CuO)=0.02 mol,则n(CuO)+n[Cu(NO3)2]=0.03 mol,n[Cu(NO3)2]=0.01 mol,m[Cu(NO3)2]=0.01mol×188g/mol=1.88 g,m(残留固体)=1.60 g+1.88 g=3.48 g,故答案为:2.32g或3.48g;
(3)取8.00g CuO,加热到1800℃左右,冷却后称得质量为6.88g,则生成的氧气的质量为8g-6.88g=1.12g,8gCuO中O元素质量为8g×$\frac{16}{80}$=1.6g>1.12g,则CuO为完全转化为Cu,剩余固体中Cu元素质量为8g-1.6g=6.4g,O元素质量为1.6g-1.12g=0.28g,剩余固体中n(Cu):n(O)=$\frac{6.4}{64}$:$\frac{0.48}{16}$=10:3,故剩余固体为Cu、Cu2O,故n(Cu2O)=n(O)=$\frac{0.48g}{16g/mol}$=0.03mol,n(Cu)=$\frac{6.4g}{64g/mol}$-0.03mol×2=0.04mol,故n(Cu2O):n(Cu)=0.03mol:0.04mol=3:4,
故答案为:n(Cu2O):n(Cu)=3:4;
(4)8.00g CuO的物质的量为$\frac{8g}{80g/mol}$=0.1mol,
令氢气还原生成的Cu的物质的量为nmol,则Cu2O的物质的量分别nxmol,则:
Cu2O+2H+=Cu+Cu2++H2O
nx n
所以nx+n=$\frac{y}{64}$,故n=$\frac{y}{64(x+1)}$,故n(Cu2O)=nx=$\frac{xy}{64(x+1)}$,
根据铜原子守恒可知,未被还原的CuO的物质的量为n(CuO)=0.1-n-2nx=0.1-$\frac{y}{64(x+1)}$-2×$\frac{xy}{64(x+1)}$=0.1-$\frac{y+2xy}{64(x+1)}$,故答案为:n(CuO)=0.1-$\frac{y+2xy}{64(x+1)}$.
点评 本题考查混合物的有关计算、根据方程式的计算等,难度较大,注意(2)根据可能的情况进行讨论计算,对学生的思维由较高的要求.

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案| A. | NaCl=Na++Cl- | B. | H2SO4=2H++SO42- | ||
| C. | Ca(OH)2=Ca2++2OH- | D. | Al2(SO4)3=Al3++SO42- |
| A. | 核外电子排布完全相同的两种微粒的化学性质一定相同 | |
| B. | 单原子形成的离子一定具有稀有气体元素原子的核外电子排布 | |
| C. | 核外电子排布相同的两种粒子一定属于同种元素 | |
| D. | 不存在质子数和电子数分别相同的阳离子和阴离子 |
| A. | 仅用新制氢氧化铜悬浊液(可以加热)不能通过化学方法完成对葡萄糖溶液、乙醇和乙酸溶液的鉴别 | |
| B. | 利用加碳酸钠饱和溶液和分液的方法可以除去乙酸乙酯中的乙酸和乙醇 | |
| C. | CH3CH2CH2OH和CH3CH2CH2Cl的同分异构体数目相同 | |
| D. | 石油的分馏、裂化,煤的干馏,都是通过化学变化获得新物质的工业生产方法 |
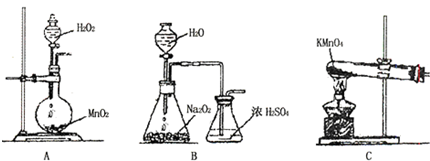
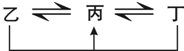 有A、B、C、D、E、F六种前四周期的元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D和F元素对应的单质为日常生活中常见金属.A原子核内只有一个质子,元素A与B形成的气态化合物甲具有10e-、空间构型为三角锥形,C元素原子的最外层电子数是其电子层数的3倍,C与E同主族.图中均含D或F元素的物质均会有图示转化关系:
有A、B、C、D、E、F六种前四周期的元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D和F元素对应的单质为日常生活中常见金属.A原子核内只有一个质子,元素A与B形成的气态化合物甲具有10e-、空间构型为三角锥形,C元素原子的最外层电子数是其电子层数的3倍,C与E同主族.图中均含D或F元素的物质均会有图示转化关系: .
.