题目内容
10.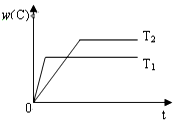 对于反应A(g)+2B(g)?2C(g),在压强相同的条件下,若生成物C的含量w(C)与时间t的关系如图所示.则下列结论正确的是( )
对于反应A(g)+2B(g)?2C(g),在压强相同的条件下,若生成物C的含量w(C)与时间t的关系如图所示.则下列结论正确的是( )| A. | T1>T2,正反应放热 | B. | T1<T2,正反应放热 | ||
| C. | T1>T2,正反应吸热 | D. | T1<T2,正反应吸热 |
分析 由图可知,T1时先达到平衡,反应速率大,则T1大;且T1时对应生成物C的含量低,则升高温度平衡逆向移动,以此来解答.
解答 解:由图可知,T1时先达到平衡,温度越高反应速率越大,则T1>T2;且T1时对应生成物C的含量低,则升高温度平衡逆向移动,可知正反应为放热反应,
故选A.
点评 本题考查化学平衡,为高频考点,把握温度对平衡移动的影响、图象分析为解答的关键,侧重分析与应用能力的考查,注意平衡移动原理的应用,题目难度不大.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
20.100mL 4mol/L 稀硫酸与2g锌粒反应,在一定温度下为了减缓反应的速率,但又不影响生成氢气的总量,可向反应物中加入( )
| A. | 硫酸钠固体 | B. | NaOH固体 | C. | 硝酸钾溶液 | D. | 氯化钾溶液 |
1.下列反应一定不能自发的是( )
| A. | 2KClO3(s)═2KCl(s)+3O2(g)△H=-78.03kJ•mol-1 △S=+1110 J•mol-1•K-1 | |
| B. | CO(g)═C(s,石墨)+$\frac{1}{2}$O2(g)△H=+110.5kJ•mol-1△S=-89.36 J•mol-1•K-1 | |
| C. | 4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)△H=-444.3kJ•mol-1△S=-280.1 J.mol-1•K-1 | |
| D. | NH4HCO3(s)+CH3COOH(aq)═CO2(g)+CH3COONH4(aq)+H2O(l)△H=+37.301kJ•mol-1△S=+184.05 J•mol-1•K-1 |
18.下列有关热化学方程式的叙述正确的是( )
| A. | 含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l);△H=-57.4kJ•mol-1 | |
| B. | 已知C(石墨,s)=C(金刚石,s);△H>0,则金刚石比石墨稳定 | |
| C. | 已知反应2H2(g)+O2(g)=2H2O(l);△H=-571.6kJ•mol-1,则H2的燃烧热为571.6kJ•mol-1 | |
| D. | 已知2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2,则△H1<△H2 |
5.下列有关说法不正确的是( )
| A. | SO42-的空间构型是正四面体形 | |
| B. | CS2分子中各原子均达8电子稳定结构 | |
| C. | 甲醛分子中碳原子的杂化类型为sp2 | |
| D. | CO2与SO2为等电子体 |
15.用NA表示阿伏加德罗常数的教值,下列说法正确的是( )
| A. | 1Ll.00mol•L-1NaCl溶浓中NaCl分子数为NA | |
| B. | 标准状况下,2.24L由N2和O2组成的混合气体中所含的原子数为0.1NA | |
| C. | 常温下,0.1molCl2溶于水时,转移的电子效是0.1NA | |
| D. | 0.lmolFe与过量稀HNO3反应时,转移的电子教为0.3NA |
2.a mol O2和a mol O3相比较一定相同的是( )
| A. | 体积 | B. | 原子数 | C. | 分子数 | D. | 质量 |
19.下列有关化学用语使用正确的是( )
| A. | NH4Br的电子式: | |
| B. | S2-的结构示意图: | |
| C. | 氦气的结构式:He-He | |
| D. | 原子核内有l7个中子的氯原子:${\;}_{17}^{35}$Cl |
20.乙酸甲酯在KOH溶液中水解,得到的产物是( )
| A. | 乙醇 | B. | 甲酸 | C. | 甲酸钾 | D. | 乙酸钾 |