题目内容
2.a mol O2和a mol O3相比较一定相同的是( )| A. | 体积 | B. | 原子数 | C. | 分子数 | D. | 质量 |
分析 结合V=nVm、N=nNA、m=nM及分子构成计算.
解答 解:A.Vm未知,相同物质的量时体积不一定相同,故A错误;
B.物质的量相同,分子中原子的物质的量分别为2amol、3amol,原子数不同,故B错误;
C.由N=nNA可知,物质的量相同,则分子数相同,故C正确;
D.二者质量分别为32ag、48ag,故D错误;
故选C.
点评 本题考查物质的量的计算,为高频考点,把握质量、物质的量、体积、微粒数的关系为解答的关键,侧重分析与计算能力的考查,注意分子的构成,题目难度不大.

练习册系列答案
相关题目
12.在一定温度下,将气体 X 和气体 Y 各 0.16mol 充入 10L 恒容密闭容器中,发生反应 X(g)+Y(g)?2Z(g)△H<0,一段时间后达到平衡.反应过程中测定的数据如表:下列说法正确的是( )
| t/min | 2 | 3 | 7 | 9 |
| n(Y)mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 反应前 2 min 的平均速率 v(Z)=2.0×10-3 mol/(L•min) | |
| B. | 其他条件不变,降低温度,反应达到新平衡前 v(逆)>v(正) | |
| C. | 该温度下此反应的平衡常数 K=1.44 | |
| D. | 其他条件不变,再充入 0.2 mol Z,平衡时 X 的体积分数增大 |
13.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O的反应中,生成28 g N2,转移的电子数目为3.75NA | |
| B. | 室温下,1 L pH=13的NaOH溶液中,由水电离的OH-数目为0.1NA | |
| C. | 氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | 标准状况下,2.24L SO3中所含原子数为0.4 NA |
10.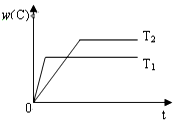 对于反应A(g)+2B(g)?2C(g),在压强相同的条件下,若生成物C的含量w(C)与时间t的关系如图所示.则下列结论正确的是( )
对于反应A(g)+2B(g)?2C(g),在压强相同的条件下,若生成物C的含量w(C)与时间t的关系如图所示.则下列结论正确的是( )
 对于反应A(g)+2B(g)?2C(g),在压强相同的条件下,若生成物C的含量w(C)与时间t的关系如图所示.则下列结论正确的是( )
对于反应A(g)+2B(g)?2C(g),在压强相同的条件下,若生成物C的含量w(C)与时间t的关系如图所示.则下列结论正确的是( )| A. | T1>T2,正反应放热 | B. | T1<T2,正反应放热 | ||
| C. | T1>T2,正反应吸热 | D. | T1<T2,正反应吸热 |
17.下列常见物质的主要成分与化学式相对应的是( )
| A. | 光导纤维一Si | B. | 铝土矿一Al2O3 | C. | 磁铁矿一Fe2O3 | D. | 纯碱一NaOH |
7.将Cl2通入200mL0.5mol•L-1氢氧化钾溶液中,二者恰好完全反应得到KCl、KClO、KClO3的混合溶液,经测定ClO-与ClO3-的物质的量之比是1:2,则通入的Cl2在标准状况下的体积为( )
| A. | 0.56L | B. | 1.68L | C. | 2.24L | D. | 1.12L |
14.设NA表示阿伏伽德罗常数的数值,下列叙述正确的是( )
| A. | 46gNO2和N2O4混合气体中含有原子总数为3NA | |
| B. | 1.7gH2O2中含有的电子数为0.8NA | |
| C. | 标准状况下,2.24L戊烷所含分子数为0.1NA | |
| D. | 1molNa与足量O2反应,生成Na2O和Na2O2的混合物,钠失去2NA个电子 |