题目内容
19.下列有关化学用语使用正确的是( )| A. | NH4Br的电子式: | |
| B. | S2-的结构示意图: | |
| C. | 氦气的结构式:He-He | |
| D. | 原子核内有l7个中子的氯原子:${\;}_{17}^{35}$Cl |
分析 A.溴离子为阴离子,电子式中需要标出最外层电子及所带电荷;
B.硫离子的核电荷数为16,核外电子总数为18,最外层满足8电子稳定结构;
C.稀有气体为单原子分子,不存在化学键;
D.氯原子的质子数为17,含有17个中子的氯原子的质量数为34.
解答 解:A.溴化铵是离子化合物,由铵根离子与溴离子构成,正确的电子式为 ,故A错误;
,故A错误;
B.S2-的核电荷数为16,最外层达到8电子稳定结构,其离子结构示意图为: ,故B正确;
,故B正确;
C.氦气为单原子分子,无法书写结构式,故C错误;
D.原子核内有l7个中子的氯原子的质量数为34,该原子正确的表示方法为:3417Cl,故D错误;
故选B.
点评 本题考查了常见化学用语的表示方法,题目难度不大,涉及离子结构示意图、电子式、结构式、元素符号等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.

练习册系列答案
相关题目
9.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,NA个CCl4分子所占的体积为22.4 L | |
| B. | 常温常压下,18 g H2O中含有的原子总数为3NA | |
| C. | 标准状况下,2.24 L SO3中含有的分子数目为0.1NA | |
| D. | 常温常压下,2.24 L CO和CO2混合气体中含有的碳原子数目为0.1NA |
10.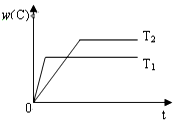 对于反应A(g)+2B(g)?2C(g),在压强相同的条件下,若生成物C的含量w(C)与时间t的关系如图所示.则下列结论正确的是( )
对于反应A(g)+2B(g)?2C(g),在压强相同的条件下,若生成物C的含量w(C)与时间t的关系如图所示.则下列结论正确的是( )
 对于反应A(g)+2B(g)?2C(g),在压强相同的条件下,若生成物C的含量w(C)与时间t的关系如图所示.则下列结论正确的是( )
对于反应A(g)+2B(g)?2C(g),在压强相同的条件下,若生成物C的含量w(C)与时间t的关系如图所示.则下列结论正确的是( )| A. | T1>T2,正反应放热 | B. | T1<T2,正反应放热 | ||
| C. | T1>T2,正反应吸热 | D. | T1<T2,正反应吸热 |
7.将Cl2通入200mL0.5mol•L-1氢氧化钾溶液中,二者恰好完全反应得到KCl、KClO、KClO3的混合溶液,经测定ClO-与ClO3-的物质的量之比是1:2,则通入的Cl2在标准状况下的体积为( )
| A. | 0.56L | B. | 1.68L | C. | 2.24L | D. | 1.12L |
14.设NA表示阿伏伽德罗常数的数值,下列叙述正确的是( )
| A. | 46gNO2和N2O4混合气体中含有原子总数为3NA | |
| B. | 1.7gH2O2中含有的电子数为0.8NA | |
| C. | 标准状况下,2.24L戊烷所含分子数为0.1NA | |
| D. | 1molNa与足量O2反应,生成Na2O和Na2O2的混合物,钠失去2NA个电子 |
4.下列实验能证明一定有二氧化硫存在的是( )
①能使澄清石灰水变浑浊;
②能使湿润的蓝色石蕊试纸变红;
③能使品红溶液褪色;
④通入足量的氢氧化钠溶液再加BaCl2溶液有白色沉淀产生,该沉淀溶于稀盐酸;
⑤通入气体能使溴水褪色,再滴加Ba(NO3)2溶液有白色沉淀产生.
①能使澄清石灰水变浑浊;
②能使湿润的蓝色石蕊试纸变红;
③能使品红溶液褪色;
④通入足量的氢氧化钠溶液再加BaCl2溶液有白色沉淀产生,该沉淀溶于稀盐酸;
⑤通入气体能使溴水褪色,再滴加Ba(NO3)2溶液有白色沉淀产生.
| A. | 只有⑤ | B. | 均能 | C. | ③④⑤ | D. | 均不能 |
8.在甲、乙、丙三种溶液中各含有Cl-、Br-、I-中的一种,向甲溶液中加入淀粉溶液和氯水时,溶液变成橙色,再加入乙溶液时,溶液颜色没有明显变化,则甲、乙、丙溶液中依次含的离子为( )
| A. | Cl-、Br-、I- | B. | Br-、I-、Cl- | C. | Br-、Cl-、I- | D. | Cl-、I-、Br- |
9.卤族元素及其化合物在生活中应用广泛.下列有关说法正确的是( )
| A. | 氟氯烃作制冷剂会加剧雾霾天气的形成 | |
| B. | 从海水中提取溴需经历氧化还原反应 | |
| C. | 加碘食盐中含有碘元素,能使淀粉溶液变蓝 | |
| D. | 工业上制漂白粉,所得的氯化物都具有漂白性 |