题目内容
20.100mL 4mol/L 稀硫酸与2g锌粒反应,在一定温度下为了减缓反应的速率,但又不影响生成氢气的总量,可向反应物中加入( )| A. | 硫酸钠固体 | B. | NaOH固体 | C. | 硝酸钾溶液 | D. | 氯化钾溶液 |
分析 n(Zn)=$\frac{2g}{65g/mol}$=0.0308mol,n(H2SO4)=4mol/L×0.1L=0.4mol>0.0308mol,所以硫酸有剩余,为了减缓锌和稀硫酸的反应速率,可以采用降低硫酸浓度的方法,但不能影响生成氢气的总量,则改变条件时不能和锌反应,以此解答该题,
解答 解:A.加入少量硫酸钠固体,硫酸钠和稀硫酸不反应,对反应速率无影响,故A错误;
B.氢氧化钠中和硫酸,如加入过多,则生成氢气的量减少,故B错误;
C.加入硝酸钾溶液时,硝酸和锌反应生成氮氧化物而不是氢气,所以生成氢气质量减少,故C错误;
D.加入氯化钾溶液时,氢离子浓度降低,反应速率减小,但生成氢气质量不变,故D正确;
故选D.
点评 本题考查化学反应速率影响因素,为高频考点,侧重考查学生的分析能力,正确判断哪种物质过量是解本题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.化学与人类生活密切相关,下列与化学有关的说法不正确的是( )
| A. | 开发和推广新能源是实现低碳生活的唯一途径 | |
| B. | 化学药品NaH着火,不能用水或泡沫灭火器灭火 | |
| C. | 食品添加剂虽能改变食物味道等,但需限量使用 | |
| D. | 化石燃料燃烧和工业废气中的氮氧化物均是导致“雾霾天气”的元凶 |
11.下列有关物质应用的说法正确的是( )
| A. | MgCl2是强电解质,电解氯化镁溶液可以制得镁 | |
| B. | 水泥冶金厂常用高压电除去工厂烟尘,利用了胶体的性质 | |
| C. | 晶体硅可用作制造太阳能电池和光导纤维 | |
| D. | 煤经过气化和液化等物理变化可以转化为清洁燃料 |
8.强酸和强碱稀溶液的中和热可表示为:H+(aq)+OH-(aq)=H2O(l),△H=-57.3kJ•mol-1
已知:
CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l)△H1,
$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l);△H2
HNO3(aq)+KOH(aq)=KNO3(aq)+H2O(l);△H3
上述反应均为在溶液中的反应,则△H1、△H2、△H3的关系正确的是( )
已知:
CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l)△H1,
$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l);△H2
HNO3(aq)+KOH(aq)=KNO3(aq)+H2O(l);△H3
上述反应均为在溶液中的反应,则△H1、△H2、△H3的关系正确的是( )
| A. | △H1=△H2=△H3 | B. | △H2<△H1<△H3 | C. | △H2=△H3>△H1 | D. | △H2=△H3<△H1 |
15.下列说法或表示方法正确的是( )
| A. | 等量的硫蒸气和硫固体分别完全燃烧,前者放出热量少 | |
| B. | 在稀溶液中:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ | |
| C. | 由C(石墨,s)→C(金刚石,s)△H=+1.5kJ/mol可知,金刚石比石墨稳定 | |
| D. | 在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l)△H=+285.8kJ/mol |
5.下列说法中,正确的是( )
| A. | 苯不与溴水反应,但苯能从溴水中提取溴单质 | |
| B. | 苯在一定条件下能发生加成反应和取代反应,但不能发生氧化反应 | |
| C. | 苯和乙烯都能使酸性KMnO4溶液褪色 | |
| D. | 苯在一定条件下与氢气、硝酸等发生加成反应 |
12.在一定温度下,将气体 X 和气体 Y 各 0.16mol 充入 10L 恒容密闭容器中,发生反应 X(g)+Y(g)?2Z(g)△H<0,一段时间后达到平衡.反应过程中测定的数据如表:下列说法正确的是( )
| t/min | 2 | 3 | 7 | 9 |
| n(Y)mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 反应前 2 min 的平均速率 v(Z)=2.0×10-3 mol/(L•min) | |
| B. | 其他条件不变,降低温度,反应达到新平衡前 v(逆)>v(正) | |
| C. | 该温度下此反应的平衡常数 K=1.44 | |
| D. | 其他条件不变,再充入 0.2 mol Z,平衡时 X 的体积分数增大 |
9.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,NA个CCl4分子所占的体积为22.4 L | |
| B. | 常温常压下,18 g H2O中含有的原子总数为3NA | |
| C. | 标准状况下,2.24 L SO3中含有的分子数目为0.1NA | |
| D. | 常温常压下,2.24 L CO和CO2混合气体中含有的碳原子数目为0.1NA |
10.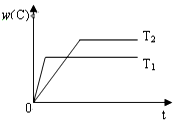 对于反应A(g)+2B(g)?2C(g),在压强相同的条件下,若生成物C的含量w(C)与时间t的关系如图所示.则下列结论正确的是( )
对于反应A(g)+2B(g)?2C(g),在压强相同的条件下,若生成物C的含量w(C)与时间t的关系如图所示.则下列结论正确的是( )
 对于反应A(g)+2B(g)?2C(g),在压强相同的条件下,若生成物C的含量w(C)与时间t的关系如图所示.则下列结论正确的是( )
对于反应A(g)+2B(g)?2C(g),在压强相同的条件下,若生成物C的含量w(C)与时间t的关系如图所示.则下列结论正确的是( )| A. | T1>T2,正反应放热 | B. | T1<T2,正反应放热 | ||
| C. | T1>T2,正反应吸热 | D. | T1<T2,正反应吸热 |