题目内容
16.为测定已部分变质的过氧化钠(假定杂质全部为碳酸钠)的纯度,设计了如下图所示的实验.图中Q为一具有良好弹性的气球(气球不参与反应,也不会被腐蚀),称取一定量的样品放入其中,按图安装的实验装置打开分液漏斗的活塞,将稀硫酸滴入气球中.请填空: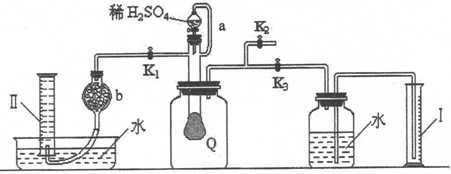
(1)Q内发生反应生成了两种气体,这两种气体的分子式为O2、CO2,写出反应的离子方程式:2Na2O2+4H+=4Na++2H2O+O2↑、CO32-+2H+=H2O+CO2↑
(2)导管a的作用是平衡分液漏斗上下的压强使顺利流下.
(3)为测定反应生成气体的总体积,滴稀硫酸前必须关闭(填K1、K2、K3,下同)K1、K2,打开K3.
(4)当上述反应停止后将K1、K2、K3处于关闭状态,然后先打开K2,再缓缓打开K1,这时可观察到的现象是气球Q慢慢缩小,量筒Ⅱ内液面下降.
(5)b中装的固体试剂是碱石灰(或生石灰,或氢氧化钠).
(6)实验结束时量筒I中有xmL水,量筒II中收集到ymL气体(体积均折算到标准状况),则过氧化钠的纯度是$\frac{78y}{53x+25y}$×100%.
分析 (1)变质的过氧化钠中含有碳酸钠,加入酸后Q内发生反应:2Na2O2+2H2SO4=2Na2SO4+2H2O+O2↑;Na2CO3+H2SO4=Na2SO4+H2O+CO2↑,据此判断气体的组成及离子方程式;
(2)为使分液漏斗内液体顺利流下,应是分液漏斗内外压强相等;
(3)反应产生的CO2、O2使气球变大,将广口瓶中气体排出,水进入量筒Ⅰ中,所以量筒Ⅰ中水的体积即为产生的CO2、O2的体积;
(4)反应停止,打开K2,再缓缓打开K1,广口瓶内外相通,气球Q慢慢缩小;
(5)混合气体通过碱石灰(或生石灰,或氢氧化钠)吸收CO2;
(6)根据化学方程式计算出碳酸钠、过氧化钠的质量并过氧化钠的纯度.
解答 解:(1)变质的过氧化钠中含有碳酸钠,加入酸后Q内发生反应:2Na2O2+2H2SO4=2Na2SO4+2H2O+O2↑、Na2CO3+H2SO4=Na2SO4+H2O+CO2↑,所以Q内发生反应生成的两种气体的分子式为 O2、CO2,这两个反应的离子方程式为2Na2O2+4H+=4Na++2H2O+O2↑、CO32-+2H+=H2O+CO2↑,
故答案为:O2、CO2;2Na2O2+4H+=4Na++2H2O+O2↑、CO32-+2H+=H2O+CO2↑;
(2)为使分液漏斗内液体顺利流下,应是分液漏斗内外压强相等,所以导管a的作用是平衡分液漏斗上下的压强使顺利流下,
故答案为:平衡分液漏斗上下的压强使顺利流下;
(3)反应产生的CO2、O2使气球变大,将广口瓶中气体排出,水进入量筒Ⅰ中,所以量筒Ⅰ中水的体积即为产生的CO2、O2的体积,所以滴稀H2SO4前必须关闭K1、K2打开K3,
故答案为:K1、K2;K3;
(4)反应停止,打开K2,再缓缓打开K1,广口瓶内外相通,气球Q慢慢缩小,量筒Ⅱ内液面下降,
故答案为:气球Q慢慢缩小,量筒Ⅱ内液面下降;
(5)混合气体通过碱石灰(或生石灰,或氢氧化钠)吸收CO2,
故答案为:碱石灰(或生石灰,或氢氧化钠);
(6)量筒I中有xmL水,则收集到的氧气的物质的量为 $\frac{y×10{\;}^{-3}}{22.4}$ mol,量筒II中收集到ymL气体,则收集到的二氧化碳的物质的量为 $\frac{(x-y)×10{\;}^{-3}}{22.4}$ mol,
2Na2O2+2H2SO4=2Na2SO4+2H2O+O2↑; Na2CO3 +H2SO4=Na2SO4+H2O+CO2↑,
$\frac{y×10{\;}^{-3}}{22.4}$×2 $\frac{y×10{\;}^{-3}}{22.4}$ $\frac{(x-y)×10{\;}^{-3}}{22.4}$ $\frac{(x-y)×10{\;}^{-3}}{22.4}$
则过氧化钠的质量为:$\frac{y×10{\;}^{-3}}{22.4}$×2×78,碳酸钠的质量为:$\frac{(x-y)×10{\;}^{-3}}{22.4}$×106,
所以过氧化钠的纯度:$\frac{m(过氧化钠)}{m(过氧化钠)+m(碳酸钠)}$×100%=$\frac{78y}{53x+25y}$×100%,
故答案为:$\frac{78y}{53x+25y}$×100%.
点评 本题考查混合物含量的测定,题目难度中等,本题要搞清量筒Ⅰ、Ⅱ的作用,根据反应的化学方程式计算即可解答,对学生的分析问题的能力及运算能力有较高的要求.

| A. | 标准状况下,1.12LCCl4含有Cl原子数目为0.4NA | |
| B. | 标准状况下,2.24L氯气中含有的电子总数为3.4mol | |
| C. | 常温常压下,4.4gCO2与N2O混合气体中含有的原子总数为0.3NA | |
| D. | 39gNa2O2与足量H2O反应,转移电子数为NA |
| A. | 与铝反应产生大题氢气的溶液:NH4+、Na+、CO32-、NO3- | |
| B. | 能使硫氰化钾溶液显红色的溶液:K+、SO42-、S2-、SO32- | |
| C. | 常温下pH值为13的溶液中:K+、HCO3-、Na+、Cl- | |
| D. | 在使石蕊试液变红的溶液中:Na+、Cu2+、Br-、SO42- |
| A. | Na2CO3 | B. | NaOH | ||
| C. | CH3COONa NaOH | D. | Na2CO3 CH3COONa |
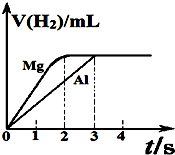 镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(v)反应时间(t)的关系如图.则下列说法正确的是( )
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(v)反应时间(t)的关系如图.则下列说法正确的是( )| A. | 镁、铝消耗硫酸的物质的量之比为2:3 | |
| B. | 参加反应的镁、铝的质量之比为4:3 | |
| C. | 反应消耗镁、铝的摩尔质量之比为2:3 | |
| D. | 反应中镁、铝转移电子的物质的量之比为2:3 |

 .
.