题目内容
11.常温下,下列各组离子在指定溶液中一定能大题共存的是( )| A. | 与铝反应产生大题氢气的溶液:NH4+、Na+、CO32-、NO3- | |
| B. | 能使硫氰化钾溶液显红色的溶液:K+、SO42-、S2-、SO32- | |
| C. | 常温下pH值为13的溶液中:K+、HCO3-、Na+、Cl- | |
| D. | 在使石蕊试液变红的溶液中:Na+、Cu2+、Br-、SO42- |
分析 A.与铝反应产生大题氢气的溶液中存在大量氢离子或氢氧根离子,碳酸根离子与氢离子反应,铵根离子与氢氧根离子反应;
B.能使硫氰化钾溶液显红色的溶液中存在铁离子,铁离子能够氧化硫离子、亚硫酸根离子离子;
C.pH=13的溶液为碱性溶液,碳酸氢根离子与氢氧根离子反应;
D.使石蕊试液变红的溶液中存在大量氢离子,四种离子之间不反应,都不与氢离子反应.
解答 解:A.与铝反应产生大题氢气的溶液为酸性或强碱性溶液,NH4+与氢氧根离子反应,CO32-与氢离子反应,在溶液中不能大量共存,故A错误;
B.能使硫氰化钾溶液显红色的溶液中存在铁离子,铁离子具有氧化性,能够氧化S2-、SO32-,在溶液中不能大量共存,故B错误;
C.pH=13的溶液中存在大量氢氧根离子,HCO3-与氢氧根离子反应,在溶液中不能大量共存,故C错误;
D.使石蕊试液变红的溶液为酸性溶液,Na+、Cu2+、Br-、SO42-之间不发生反应,都不与氢离子反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.氢氧化钠溶于水,溶液温度显著升高的原因是( )
| A. | 氢氧化钠溶于水只发生扩散作用 | |
| B. | 氢氧化钠溶于水只发生水合作用 | |
| C. | 氢氧化钠溶于水扩散过程吸收热量大于水合过程放出的热量 | |
| D. | 氢氧化钠溶于水扩散过程吸收热量小于水合过程放出的热量 |
6.下列有关设计方案能达到实验目的是( )
| A. | 制备Fe(OH)3胶体:向0.1mol•L-1FeCl3溶液中加入等体积0.3mol•L-1NaOH溶液 | |
| B. | 除去FeCl3溶液中少量Cu2+:向含有少量Cu2+的FeCl3溶液中加入适量铁粉至蓝色刚好消失后过滤 | |
| C. | 配制1mol/LMgSO4溶液:将12.0gMgSO4固体倒进100mL容量瓶中,然后加入100mL蒸馏水 | |
| D. | 确定Na2CO3溶液中是否混有NaOH:取少量溶液滴加过量BaCl2溶液,过滤取滤液,在滤液中滴加酚酞,观察是否出现红色 |
20.在标准状况下,由CO和CO2组成的混合气体13.44L,其质量为24g,此混合气体中C和O两种原子的物质的量之比是( )
| A. | 3:7 | B. | 3:4 | C. | 4:7 | D. | 1:3 |
1.用硫酸、盐酸、醋酸、钠盐、钾盐、钡盐相互反应,符合离子方程式2H++CO32-═H2O+CO2↑的反应个数有
( )
( )
| A. | 4个 | B. | 5个 | C. | 8个 | D. | 12个 |
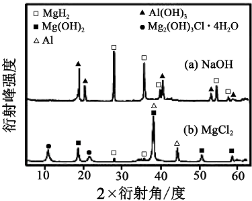
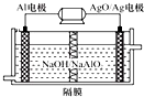
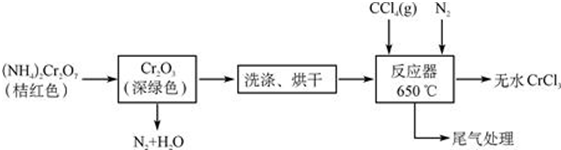
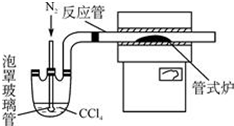
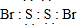 ;
;