题目内容
6.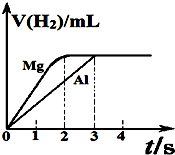 镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(v)反应时间(t)的关系如图.则下列说法正确的是( )
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(v)反应时间(t)的关系如图.则下列说法正确的是( )| A. | 镁、铝消耗硫酸的物质的量之比为2:3 | |
| B. | 参加反应的镁、铝的质量之比为4:3 | |
| C. | 反应消耗镁、铝的摩尔质量之比为2:3 | |
| D. | 反应中镁、铝转移电子的物质的量之比为2:3 |
分析 镁和铝分别与等浓度、等体积的过量稀硫酸反应,则金属完全反应,最终生成氢气体积相同,由氢原子守恒可知,消耗硫酸物质的量相等,金属提供电子相等,根据电子转移守恒计算二者物质的量之比,再根据m=nM计算质量之比.
解答 解:A.镁和铝分别与等浓度、等体积的过量稀硫酸反应,则金属完全反应,最终生成氢气体积相同,由氢原子守恒可知,消耗硫酸物质的量相等,故A错误;
B.金属提供电子相等,则2n(Mg)=3n(Al),故n(Mg):n(Al)=3:2,参加反应的镁、铝的质量之比是3mol×24g/mol:2mol×27g/mol=4:3,故B正确;
C.镁、铝的摩尔质量之比是24:27=8:9,故C错误;
D.金属提供电子相等,则2n(Mg)=3n(Al),故n(Mg):n(Al)=3:2,故D错误,
故选:B.
点评 本题以图象形式考查化学方程式计算,注意利用守恒进行解答,较好的考查学生读图能力、分析计算能力,难度不大.

练习册系列答案
相关题目
17.胶体区别于其它分散系最本质的特征是( )
| A. | 外观澄清、稳定 | B. | 分散质粒子直径为1---100nm | ||
| C. | 分散至粒子能透过半透膜 | D. | 丁达尔现象 |
14.下列反应属于吸热反应的是( )
| A. | 石灰石在高温下的分解反应 | B. | 金属钠和水的反应 | ||
| C. | 盐酸与氢氧化钠溶液的反应 | D. | 木炭在氧气中燃烧 |
1.用硫酸、盐酸、醋酸、钠盐、钾盐、钡盐相互反应,符合离子方程式2H++CO32-═H2O+CO2↑的反应个数有
( )
( )
| A. | 4个 | B. | 5个 | C. | 8个 | D. | 12个 |
11.甲溶液的pH=2,乙溶液的pH=4,甲溶液与乙溶液的c(H+)之比是( )
| A. | 1:2 | B. | 2:1 | C. | 1:100 | D. | 100:1 |
18.在25℃时,某稀溶液中由水电离产生的c(OH-)=10-10 mol•L-1.下列有关该溶液的叙述正确的是( )
| A. | 该溶液一定呈酸性 | |
| B. | 该溶液中c(H+)可能等于10-5 mol•L-1 | |
| C. | 该溶液的pH可能为4也可能为10 | |
| D. | 该溶液有可能呈中性 |
15.有两个无标签的试剂瓶,分别盛有固体K2CO3、NaHCO3,有四位同学为鉴别它们采用了以下不同方法,其中不可行的是( )
| A. | 分别将它们配制成溶液,再加入澄清石灰水,观察是否有沉淀产生 | |
| B. | 分别将它们配制成溶液,再进行焰色反应,观察火焰颜色 | |
| C. | 分别将它们配制成溶液,再加入BaCl2溶液,观察是否有沉淀产生 | |
| D. | 分别加热,再用澄清石灰水检验是否有气体产生 |
16.固体单质A和气体单质B在容积一定的密闭容器中完全反应生成气体C,同温下测得容器内压强不变,且反应后气体C的密度是原容器中气体密度的4倍.则下列判断正确的是( )
| A. | 生成的气体C为单质,且B和C的摩尔质量比为1:4 | |
| B. | 生成物C中A的质量分数为75% | |
| C. | 生成物C中A、B的原子个数比为3:1 | |
| D. | 反应前后气体分子数比为1:4 |