题目内容
18.下列说法正确的是( )| A. | T℃时,测得某NaNO2溶液的pH=8,则溶液中c(Na+)_c(NO2-)=9.9×10-7mol•L-1 | |||||||||
| B. | 已知H3PO2(次磷酸)是一种一元中强酸,则其与NaOH所形成的酸式盐NaH2PO2溶液中存在下列离子浓度大小关系c(Na+)>c(H2PO2-)c(OH-)>c(H+) | |||||||||
| C. | 一定温度下,利用pH计测定不同浓度醋酸溶液的pH值,得到如表数据:
| |||||||||
| D. |  已知,某温度时Ag2SO4在水中的沉淀溶解平衡曲线如图,可知Ag2SO4在此温度下的溶度积常数(Ksp)为8×10-4 |
分析 A.NaNO2溶液的pH=8,c(H+)10-8mol/L,但温度不知不能确定氢氧根离子浓度,依据电荷守恒的无法计算c(Na+)_c(NO2-);
B.已知H3PO2(次磷酸)是一种一元中强酸,则其与NaOH所形成的盐为正盐;
C.根据溶液pH和醋酸浓度计算电离度;
D.根据ksp=c2(Ag+)×c(SO42-)计算;
解答 解:A.如在常温下,由电荷守恒可知NaNO2溶液存在:c(Na+)+c(H+)=c(OH-)+c(NO2-),则c(Na+)-c(NO2-)=c(OH-)-c(H+)=1×10-6mol•L-1-1×10-8mol•L-1=9.9×10-7mol•L-1,但由于温度不确定,则不能确定溶液c(OH-)大小,故A错误;
B.已知H3PO2(次磷酸)是一种一元中强酸,则其与NaOH所形成的盐NaH2PO2为正盐,故B错误;
C.pH=3,则c(CH3COO-)=c(H+)=0.001mol/L,则醋酸的电离度为$\frac{0.001mol/L}{0.1mol/L}$=1%,故C正确;
D.由图象可知,当c(SO42-)=16×10-2mol/L时,c(Ag+)=1×10-2mol/L,则ksp=c2(Ag+)×c(SO42-)=1.6×10-6,故D错误;
故选C.
点评 本题综合考查弱电解质的电离、电离程度大小计算、溶度积常数计算、图象的理解应用,为高考常见题型和高频考点,侧重于学生的分析能力和计算能力的考查,注意相关计算公式的运用,注意已知H3PO2(次磷酸)是一种一元中强酸,则其与NaOH所形成的盐NaH2PO2为正盐,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.某溶液中存在大量的NH4+、Ba2+、Cl-,该溶液中还可能大量存在的是( )
| A. | SO42一 | B. | K+ | C. | Ag+ | D. | OH- |
9.已知常温下0.1mol/L的NH4HCO3溶液pH=7.8,该溶液中含氮、含碳各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如图所示.下列说法正确的是( )
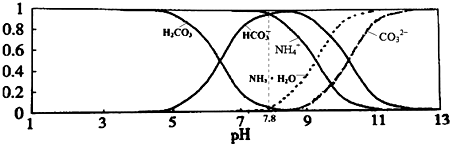

| A. | 当溶液的pH=9时,溶液中存在下列关系:c(NH4+)>c(HCO3-)>c(NH3•H2O)>c(CO32-) | |
| B. | NH4HCO3溶液中存在下列守恒关系:c(NH4+)+c(NH3•H2O)+c(H+)=c(OH-)+2c(CO32-)+c(H2CO3) | |
| C. | 由图可知,往该溶液中逐滴滴加氢氧化钠时NH4+浓度逐渐减小,HCO3-浓度先增大后减小 | |
| D. | 通过分析可知常温下:Ka1(H2CO3)>Kb(NH3•H2O)>Ka2(H2CO3) |
3.NCl3的电子式为 ,则NCl3与H2O反应时.最初的生成物一定有( )
,则NCl3与H2O反应时.最初的生成物一定有( )
 ,则NCl3与H2O反应时.最初的生成物一定有( )
,则NCl3与H2O反应时.最初的生成物一定有( )| A. | NH3 | B. | HNO2 | C. | HClO | D. | NH4Cl |
10.在溶液中能大量共存的一组离子或分子是( )
| A. | NH4+、H+、NO3-、HCO3- | B. | K+、AlO2-、SO42-、NH3•H2O | ||
| C. | Na+、K+、SO32-、ClO- | D. | Na+、CH3COO-、SO42-、H+ |
17.5.0g金属混合物与足量稀盐酸反应,收集到2.8LH2(标准状况),这种混合物可能的组成是( )
| A. | Fe和Zn | B. | Mg和Al | C. | Fe、Cu、Zn | D. | Mg、Fe、Cu |
18.下列说法正确的是( )
| A. | 油脂属于高分子化合物 | B. | 糖类都能水解 | ||
| C. | 酶是一类具有催化作用的蛋白质 | D. | 淀粉和纤维素属于同分异构体 |
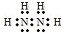 .
.