题目内容
15.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )| A. | 标准状况下,11.2L CCl4所含的分子数为0.5NA | |
| B. | 将含有0.1mol FeCl3的饱和溶液,滴入沸水中加热形成Fe(OH)3胶体,所含的胶体粒子数目少于0.1NA | |
| C. | 1mol/L的氯化钠溶液中,所含离子数为NA | |
| D. | 常温下,CO和N2混合物共2.8g,所含有的原子数为0.1NA |
分析 A.气体摩尔体积使用对象为气体;
B.胶体为多个离子的集合体;
C.溶液体积未知;
D.CO和N2都是双原子分子,摩尔质量相等为28g/mol.
解答 解:A.标况下四氯化碳为液体,不能使用气体摩尔体积,故A错误;
B.将含有0.1mol FeCl3的饱和溶液,滴入沸水中加热形成Fe(OH)3胶体,所含的胶体粒子数目少于0.1NA,故B正确;
C.溶液体积未知,无法计算离子个数,故C错误;
D.常温下,CO和N2混合物共2.8g,物质的量为:$\frac{2.8g}{28g/mol}$=0.1mol,所含有的原子数为0.2NA,故D错误;
故选:B.
点评 本题考查阿伏加德罗常数的有关计算和判断,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系,题目难度中等.

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
6.硫代硫酸钠晶体(Na2S2O3•5H2O)在化学定量分析中常用作基准物质.它易溶于水,难溶于乙醇,加热、遇酸均易分解.某实验小组设计如下装置模拟工业生产制备硫代硫酸钠晶体(夹持仪器和加热装置省略).
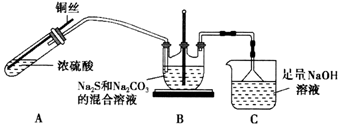
实验步骤如下:
①加热装置A,控制反应速率,使A中产生的气体均匀的通入B中,同时不断搅动,加热.
②当溶液的pH接近7时,停止通入SO2气体.
③将反应后的溶液转移至蒸发皿中,蒸发浓缩,到溶液表面出现晶膜时停止加热.再经冷却结晶、过滤、洗涤,将晶体放入烘箱中,在40℃左右干燥50~60min,得到产品.
回答下列问题:
(1)步骤①,在装置B中反应生成Na2S2O3,已知反应中只有一种变价元素,则B中反应的离子方程式为2S2-+CO32-+4SO2$\frac{\underline{\;\;△\;\;}}{\;}$3S2O32-+CO2.
(2)步骤②当溶液的pH接近7时,停止通入SO2气体的原因是Na2S2O3遇酸易分解,二氧化硫过量会使溶液的酸性增强,使产率降低.
(3)若要停止A中的化学反应,除熄灭酒精灯外,还可以采取的措施是将铜丝抽离液面.
(4)完成步骤③中的两处实验操作:蒸发浓缩、冷却结晶.
(5)为探究实验后装置C中溶液的溶质成分,该实验小组又进行了如下实验.
供选择的试剂为:Al(OH)3粉末、酚酞试液、稀硫酸、稀硝酸、Ba(NO3)2溶液

实验步骤如下:
①加热装置A,控制反应速率,使A中产生的气体均匀的通入B中,同时不断搅动,加热.
②当溶液的pH接近7时,停止通入SO2气体.
③将反应后的溶液转移至蒸发皿中,蒸发浓缩,到溶液表面出现晶膜时停止加热.再经冷却结晶、过滤、洗涤,将晶体放入烘箱中,在40℃左右干燥50~60min,得到产品.
回答下列问题:
(1)步骤①,在装置B中反应生成Na2S2O3,已知反应中只有一种变价元素,则B中反应的离子方程式为2S2-+CO32-+4SO2$\frac{\underline{\;\;△\;\;}}{\;}$3S2O32-+CO2.
(2)步骤②当溶液的pH接近7时,停止通入SO2气体的原因是Na2S2O3遇酸易分解,二氧化硫过量会使溶液的酸性增强,使产率降低.
(3)若要停止A中的化学反应,除熄灭酒精灯外,还可以采取的措施是将铜丝抽离液面.
(4)完成步骤③中的两处实验操作:蒸发浓缩、冷却结晶.
(5)为探究实验后装置C中溶液的溶质成分,该实验小组又进行了如下实验.
供选择的试剂为:Al(OH)3粉末、酚酞试液、稀硫酸、稀硝酸、Ba(NO3)2溶液
| 序号 | 操作及现象 | 结论 |
| ① | 取少量Al(OH)3粉末于试管中,滴加适量溶液,振荡,白色粉末溶解 | 溶质中一定含有NaOH |
| ② | 取2nL溶液于试管中,滴加足量氯水,氯水褪色丙有气泡产生,再滴加几滴Ba(NO3)2溶液,有白色沉淀产生 | 溶质为NaOH和 Na2CO3、Na2SO3 |
| 取2mL溶液于试管中,若 先加入足量稀硝酸,产生气泡,再滴入几滴Ba(NO3)2溶液,无沉淀产生 | 溶质为为NaOH和Na2CO3 |
3.下列气体既可以用浓硫酸干燥,也可以用碱石灰干燥的是( )
| A. | CO2 | B. | Cl2 | C. | NH3 | D. | H2 |
10.下列各组物质相互混合反应后,最终有白色沉淀生成的是( )
①金属钠投入到FeCl2溶液中
②过量NaOH溶液和明矾溶液混合
③少量Ca(OH)2投入过量NaHCO3溶液中
④向饱和Na2CO3溶液中通入过量CO2.
①金属钠投入到FeCl2溶液中
②过量NaOH溶液和明矾溶液混合
③少量Ca(OH)2投入过量NaHCO3溶液中
④向饱和Na2CO3溶液中通入过量CO2.
| A. | ①②③④ | B. | ①④ | C. | ③④ | D. | ②③ |
20.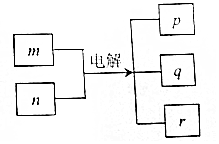 短周期元素W、X、Y、Z的原子序数依次增加.m、n、r是由这些元素组成的化合物,p、q分别是元素W、Z的气体单质.r溶液是实验室中常见试剂,常温下0.1mol•L-1r溶液的pH为13,工业上制备r和q的反应如图所示,下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增加.m、n、r是由这些元素组成的化合物,p、q分别是元素W、Z的气体单质.r溶液是实验室中常见试剂,常温下0.1mol•L-1r溶液的pH为13,工业上制备r和q的反应如图所示,下列说法正确的是( )
 短周期元素W、X、Y、Z的原子序数依次增加.m、n、r是由这些元素组成的化合物,p、q分别是元素W、Z的气体单质.r溶液是实验室中常见试剂,常温下0.1mol•L-1r溶液的pH为13,工业上制备r和q的反应如图所示,下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增加.m、n、r是由这些元素组成的化合物,p、q分别是元素W、Z的气体单质.r溶液是实验室中常见试剂,常温下0.1mol•L-1r溶液的pH为13,工业上制备r和q的反应如图所示,下列说法正确的是( )| A. | 单质的沸点:W>X | |
| B. | 简单离子半径:Z>Y>X | |
| C. | W与其他3种元素均能形成共价化合物 | |
| D. | X与其他3种元素均可形成至少两种二元化合物 |
5.下列四种溶液中,水的电离程度最大的是( )
| A. | pH=5的NH4Cl溶液 | B. | pH=5的NaHSO4溶液 | ||
| C. | pH=5盐酸溶液 | D. | pH=8的NaOH溶液 |
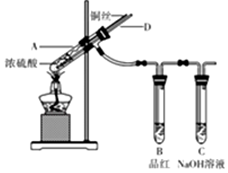 某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验,实验装置如图所示:
某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验,实验装置如图所示: