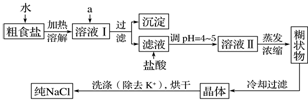
题目内容
12.配制500L0.5mol•L-1的盐酸溶液,需要标准状况下的HCl气体多少升?分析 依据n=CV=$\frac{V}{Vm}$计算解答.
解答 解:配制500L0.5mol•L-1的盐酸溶液,需要氯化氢的物质的量n=CV=0.5mol/L×0.5L=0.25mol,标况下体积V=nVm=0.25mol×22.4L/mol=5.6L;
答:配制500L0.5mol•L-1的盐酸溶液,需要标准状况下的HCl气体5.6升.
点评 本题考查了一定物质的量浓度溶液配制,侧重考查有关物质的量计算,熟悉以物质的量为核心的计算公式是解题关键,题目难度不大.

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案
相关题目
20. 2SO2(g)+O2(g)?2SO3(g)反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )
2SO2(g)+O2(g)?2SO3(g)反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )
 2SO2(g)+O2(g)?2SO3(g)反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )
2SO2(g)+O2(g)?2SO3(g)反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )| A. | △H=E2-E1 | |
| B. | 反应物断键吸收的总能量小于生成物成键释放的总能量 | |
| C. | 升高温度,不影响活化分子百分数 | |
| D. | 使用催化剂使该反应的反应热发生改变 |
17.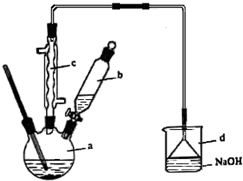 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
在a中加入15mL无水苯和少量铁屑,在b中小心加入4.0mL液态溴,回答下列问题:
(1)c仪器的名称是球形冷凝管,向a中滴加几滴溴,有白雾产生,是因为生成了HBr气体,a中发生反应的化学方程式为 .该反应的类型是取代反应;装置d的作用是吸收HBr和Br2;
.该反应的类型是取代反应;装置d的作用是吸收HBr和Br2;
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤,NaOH溶液洗涤的作用是除去HBr和未反应的Br2;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤,加入氯化钙的目的是吸水(干燥).
(3)经过上述分离操作后,粗溴苯中还含有的主要杂质为苯,要进一步提纯,应选择下列C操作(填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取.
 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
(1)c仪器的名称是球形冷凝管,向a中滴加几滴溴,有白雾产生,是因为生成了HBr气体,a中发生反应的化学方程式为
 .该反应的类型是取代反应;装置d的作用是吸收HBr和Br2;
.该反应的类型是取代反应;装置d的作用是吸收HBr和Br2;(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤,NaOH溶液洗涤的作用是除去HBr和未反应的Br2;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤,加入氯化钙的目的是吸水(干燥).
(3)经过上述分离操作后,粗溴苯中还含有的主要杂质为苯,要进一步提纯,应选择下列C操作(填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取.
1.为配制0.01mol•L-1 的KMnO4 消毒液,下列操作导致所配溶液浓度偏高的是( )
| A. | 溶解搅拌时有液体飞溅 | |
| B. | 取KMnO4样品时不慎在表面沾了点蒸馏水 | |
| C. | 定容时俯视容量瓶刻度线 | |
| D. | 定容摇匀后见液面下降,再加水至刻度线 |
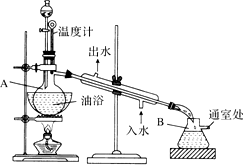 乙酸乙酯是无色的有水果香味的液体,沸点77.1℃,实验室某次制取它用冰醋酸14.3mL,95%乙醇23mL,还用到浓H2SO4,饱和Na2CO3溶液以及极易与乙醇结合成六醇合物的氯化钙溶液,主要仪器装置如图所示,实验步骤是:①先向A蒸馏烧瓶中注入少量乙醇和所用的浓H2SO4后摇匀,再将剩下的所有乙醇和冰醋酸注入分液漏斗待用,这时分液漏斗里乙醇与冰醋酸的物质的量之比约为7:5;②加热油浴,保持温度在135℃~145℃之间;③将分液漏斗中的液体缓缓滴入蒸馏烧瓶里,调节加料速度使蒸出酯的速度与进料速度大体相等,直到加料完成;④保持油浴温度一段时间,至不再有液体馏出后,停止加热;⑤取下B吸滤瓶,将一定量饱和Na2CO3溶液分批少量多次地加到馏出液里,边加边摇荡,直到无气泡产生为止;⑥将⑤的液体混合物分液,弃去水层;⑦将饱和CaCl2溶液(适量)加入到分液漏斗中,摇荡一段时间静置,放出水层(废液);⑧分液漏斗里得到的是初步提纯的乙酸乙酯粗品;⑨然后再向其中加入无水硫酸钠,振荡.
乙酸乙酯是无色的有水果香味的液体,沸点77.1℃,实验室某次制取它用冰醋酸14.3mL,95%乙醇23mL,还用到浓H2SO4,饱和Na2CO3溶液以及极易与乙醇结合成六醇合物的氯化钙溶液,主要仪器装置如图所示,实验步骤是:①先向A蒸馏烧瓶中注入少量乙醇和所用的浓H2SO4后摇匀,再将剩下的所有乙醇和冰醋酸注入分液漏斗待用,这时分液漏斗里乙醇与冰醋酸的物质的量之比约为7:5;②加热油浴,保持温度在135℃~145℃之间;③将分液漏斗中的液体缓缓滴入蒸馏烧瓶里,调节加料速度使蒸出酯的速度与进料速度大体相等,直到加料完成;④保持油浴温度一段时间,至不再有液体馏出后,停止加热;⑤取下B吸滤瓶,将一定量饱和Na2CO3溶液分批少量多次地加到馏出液里,边加边摇荡,直到无气泡产生为止;⑥将⑤的液体混合物分液,弃去水层;⑦将饱和CaCl2溶液(适量)加入到分液漏斗中,摇荡一段时间静置,放出水层(废液);⑧分液漏斗里得到的是初步提纯的乙酸乙酯粗品;⑨然后再向其中加入无水硫酸钠,振荡.