题目内容
4.ClO2作为一种广谱型的消毒剂,将逐渐用来取代Cl2成为自来水的消毒剂.已知ClO2是一种易溶于水而难溶于有机溶剂的气体,实验室制备ClO2的原理是用亚氯酸钠固体与纯净的氯气反应 2NaClO2+Cl2═2ClO2+2NaCl如图1是实验室用于制备和收集一定量纯净的ClO2的装置(某些夹持装置和垫持用品省略).其中E中盛有CCl4液体.

(1)仪器P的名称是分液漏斗
(2)写出装置A中烧瓶内发生反应的化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
(3)E装置中所盛试剂的作用是用于除去ClO2中未反应的Cl2
(4)F处应选用的收集装置是图2②(填序号),其中与E装置导管相连的导管口是图2d(填接口字母).
(5)以下是尾气吸收装置,能用于吸收多余ClO2气体,并能防止倒吸的装置的是如图3的D
A.①②B.②③C.③④D.②④
(6)若用100mL 2mol•L-1的浓盐酸与足量的MnO2制备Cl2,则被氧化的HCl的物质的量是C(填序号).
A.>0.1mol B.0.1molC.<0.1mol D.无法判断.
(7)ClO2也可由NaClO3在H2SO4溶液存在下与Na2SO3反应制得.请写出反应的化学方程式:2ClO3-+SO32-+2H+═2ClO2+SO42-+H2O.
分析 由实验装置可知,A中制备氯气,B中除去HCl,C干燥氯气,D中发生2NaClO2+Cl2═2ClO2+2NaCl,ClO2是一种易溶于水而难溶于有机溶剂的气体,E中盛有CCl4液体,E吸收ClO2中的Cl2,F收集气体,G为缓冲装置可防止倒吸,最后连接尾气处理装置.
(1)由图可知,P为分液漏斗;
(2)A中浓盐酸与二氧化锰加热生成氯气;
(3)E装置可除去杂质;
(4)ClO2的密度比空气密度大,且与后面的装置连接;
(5)尾气吸收装置,能用于吸收多余ClO2气体,并能防止倒吸,则气体与液体不能直接接触;
(6)浓盐酸与足量的MnO2制备Cl2,随反应的进行,浓度变小,稀盐酸与二氧化锰不反应;
(7)NaClO3在H2SO4溶液存在下与Na2SO3反应,生成Na2SO4、ClO2、H2O.
解答 解:(1)实验室用浓盐酸和MnO2在加热条件下反应制备Cl2,浓盐酸应盛装在分液漏斗中,则P为分液漏斗,故答案为:分液漏斗;
(2)浓盐酸和MnO2在加热条件下反应制备Cl2,反应的方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(3)ClO2是一种易溶于水而难溶于有机溶剂的气体,生成的ClO2中混有氯气,氯气易溶于四氯化碳,为制备纯净干燥的ClO2,使用四氯化碳来除去氯气,
故答案为:用于除去ClO2中未反应的Cl2;
(4)ClO2是一种易溶于水的气体,且密度比空气大,应用向上排空气法收集,且进行尾气处理,故用双孔橡皮塞,
故答案为:②;d;
(5)ClO2是一种易溶于水的气体,尾气吸收时要防止倒吸,导气管不能插入到液面以下,②④符合,
故答案为:D;
(6)浓盐酸在加热条件下与二氧化锰发生氧化还原反应,但随着反应的进行,盐酸浓度变稀时,不与二氧化锰反应,根据MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O可知,若用100mL 2mol•L-1的浓盐酸与足量的MnO2制备Cl2,则被氧化的HCl的物质的量<0.1mol,
故答案为:C;
(7)KClO3在H2SO4存在下与Na2SO3反应,SO32-被氧化成SO42-,由电子、电荷守恒可知该离子反应为2ClO3-+SO32-+2H+═2ClO2+SO42-+H2O,
故答案为:2ClO3-+SO32-+2H+═2ClO2+SO42-+H2O.
点评 本题考查物质的制备实验,为高频考点,把握制备原理、发生的反应、实验装置的作用、实验技能为解答的关键,侧重分析与实验能力的考查,注意氧化还原反应及习题信息的应用,题目难度不大.

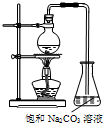 酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、纺织等工业.乙酸乙酯的实验室和工业制法如下:
酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、纺织等工业.乙酸乙酯的实验室和工业制法如下:CH3COOH+C2H5OH$\frac{\underline{\;浓硫酸\;}}{△}$CH3COOC2H5+H2O
回答下列问题:
(1)欲提高乙酸的转化率,可采取的措施有(答出2点即可):增大乙醇浓度、移去生成物等.
(2)若用如图所示装置制备乙酸乙酯,产率往往偏低.其原因是(答出2点即可):原料来不及反应就被蒸出,或温度过高发生副反应;
(3)此反应以浓硫酸为催化剂,可能会造成(答出2点即可)产生大量酸性废液污染环境,或部分原料炭化等问题.
(4)目前对催化剂进行研究,发现质子酸(能提供H+)离子液体可用作此反应的催化剂,且能重复使用.实验数据如下(乙酸和乙醇等物质的量):
| 同一反应时间 | 同一反应温度 | ||||
| 反应温度 | 转化率(%) | 选择性(%) | 反应时间 | 转化率(%) | 选择性(%) |
| 40℃ | 77.8 | 100 | 2h | 80.2 | 100 |
| 60℃ | 92.3 | 100 | 3h | 87.8 | 100 |
| 80℃ | 92.6 | 100 | 4h | 92.3 | 100 |
| 120℃ | 94.5 | 98.7 | 6h | 93 | 100 |
| 注:选择性100%表示反应生成的产物是乙酸乙酯和水 | |||||
A.120℃,4h B.80℃,2h C.60℃,4h D.40℃,3h
②当反应达到120℃时,反应选择性降低的原因可能是:乙醇脱水生成乙醚.
| A. | 2CO (g )+O2(g )═2CO2(g );△H=-556kJ•mol-1 | |
| B. | CH4(g )+2O2 (g )═CO2(g )+2H2O (l );△H=-890kJ•mol-1 | |
| C. | 2H2(g )+O2(g )═2H2O(l );△H=-571.6kJ•mol-1 | |
| D. | 2H2(g )+2 Cl2 (g )═4HCl (g);△H=-369.2kJ•mol-1 |
| A. | 硝酸钾、氢氧化钠 | B. | 氧化铜、二氧化锰 | C. | 氯化钾、二氧化锰 | D. | 硫酸铜、氢氧化钡 |
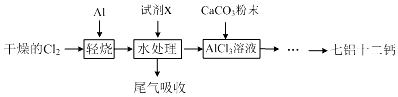
(1)轻烧后的气体用水处理前导气管为何要保温?为了防止AlC13蒸气凝华堵塞导气管
(2)用水处理添加的试剂X是盐酸,其目的是抑制铝离子水解.
(3)AlC13溶液溶解CaCO3时,要控制碳酸钙和AlC13的量,要求n(CaCO3):n(A1C13)>12:14,其原因是氢氧化钙微溶于水,造成损失.用氨水沉淀、过滤后的滤液主要成分是NH4Cl(少量CaCl2).
(4)以工业碳酸钙(含有少量A12O3、Fe3O4杂质)生产二水合氯化钙(CaC12•2H2O)的方法为:将工业碳酸钙溶于盐酸,加入双氧水,加入氢氧化钙,搅拌,用pH计调节溶液的pH为4.7,过滤.(实验中需用到的试剂和仪器有:盐酸,双氧水,氢氧化钙,冰水,pH计).
已知:几种离子生成氢氧化物沉淀pH(开始沉淀的pH按金属离子浓度为1.0mol/L计算)
| 开始沉淀的pH | 完全沉淀的pH | |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.5 | 4.7 |
| A. | N2和O2的反应 | B. | Na和O2的反应 | C. | Fe和Cl2的反应 | D. | 铜和硝酸的反应 |
| A. | 电解法精炼铜是,以粗铜作阴极,精铜作阳极 | |
| B. | 加热0.1mol/L的Na2CO3溶液,CO32-的水解程度和溶液的pH均增大 | |
| C. | 1L 1mol/L的NaClO溶液中含有ClO-的数目为6.02×1023 | |
| D. | 相同条件下,溶液中Fe2+、Cu2+、Zn2+的氧化性依次减弱 |