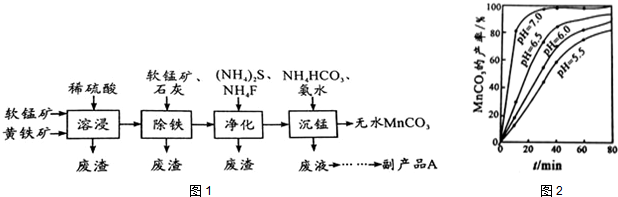
题目内容
7.食盐是日常生活的必需品,也是重要的化工原料.粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下: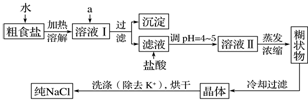
提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇、四氯化碳
(1)欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为NaOH、BaCl2、Na2CO3(或BaCl2、NaOH、Na2CO3或BaCl2、Na2CO3、NaOH)(只填化学式).
(2)洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为75%乙醇.
(3)如何检验NaCl已洗涤干净?(简述方法、现象和结论)取最后一次的洗涤液少许,做焰色反应,透过蓝色钴玻璃未看到紫色,说明已洗净.
(4)用提纯的NaCl配制480mL 4.00mol•L-1NaCl溶液,需要用托盘天平称取NaCl的质量117.0g.
(5)用惰性电极电解饱和食盐水,如何检验阳极产生的气体?(简述过程,描述现象,结论)将湿润的淀粉-KI试纸靠近阳极,若试纸变蓝,说明产生氯气.
分析 粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,由实验可知,加热溶解后,加NaOH除去Mg2+、Fe3+,加氯化钡除去SO42-,加碳酸钠除去Ca2+、Ba2+,碳酸钠一定在氯化钡之后,然后过滤,滤液中加盐酸除去过量碳酸钠溶液,调节pH后蒸发浓缩,洗涤NaCl晶体表面附带的少量KCl,NaCl在酒精中溶解度小,利用75%酒精洗涤,烘干得到NaCl,检验氯化钠中氯离子需要硝酸、硝酸银,电解氯化钠溶液在阳极生成氯气,氯气可使湿润的淀粉-KI试纸变蓝,以此来解答.
解答 解:(1)欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为NaOH、BaCl2、Na2CO3(或BaCl2、NaOH、Na2CO3或BaCl2、Na2CO3、NaOH),碳酸钠一定在氯化钡之后,
故答案为:NaOH、BaCl2、Na2CO3(或BaCl2、NaOH、Na2CO3或BaCl2、Na2CO3、NaOH);
(2)洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为75%乙醇,故答案为:75%乙醇;
(3)检验NaCl已洗涤干净的方法为取最后一次的洗涤液少许,做焰色反应,透过蓝色钴玻璃未看到紫色,说明已洗净,
故答案为:取最后一次的洗涤液少许,做焰色反应,透过蓝色钴玻璃未看到紫色,说明已洗净;
(4)配制480mL 4.00mol•L-1NaCl溶液,需要用托盘天平称取NaCl的质量为0.5L×4.00mol/L×58.5g/mol=117.0g,故答案为:117.0;
(5)用惰性电极电解饱和食盐水,检验阳极产生的气体的操作为将湿润的淀粉-KI试纸靠近阳极,若试纸变蓝,说明产生氯气,故答案为:将湿润的淀粉-KI试纸靠近阳极,若试纸变蓝,说明产生氯气.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、流程中发生的反应、混合物分离提纯、溶液配制及电解等为解答的关键,侧重分析与实验能力的考查,注意碳酸钠一定在氯化钡之后,题目难度不大.

 香蕉水主要用作喷漆的溶剂和稀释剂,其主要成分乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味.实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
香蕉水主要用作喷漆的溶剂和稀释剂,其主要成分乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味.实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
| 物质名称 | 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
实验步骤:
在A中加入4.4g异戊醇、6.0g乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A(加热和夹持装置略),回流50min.反应液冷至室温后倒入分液漏斗中,先用少量水、饱和碳酸氢钠溶液洗,再用水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g.
回答下列问题:
(1)若在实验过程中发现忘记加入碎片,则应采取的措施是停止加热,待反应液冷却后加入碎瓷片.
(2)在洗涤操作中第二次用水洗的主要目的是洗掉碳酸氢钠.
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后粗产品应从分液漏斗的上(填“上”或“下”)口分离出.
(4)实验中加入少量无水MgSO4的目的是干燥.
(5)本实验的产率是c(填标号).
a.30% b.40% c.60% d.90%
(6)在进行蒸馏操作时,发现实验的产率偏高,其可能原因是未到140℃就收集馏分(会收集少量未反应的异戊醇).
| A. | 2CO (g )+O2(g )═2CO2(g );△H=-556kJ•mol-1 | |
| B. | CH4(g )+2O2 (g )═CO2(g )+2H2O (l );△H=-890kJ•mol-1 | |
| C. | 2H2(g )+O2(g )═2H2O(l );△H=-571.6kJ•mol-1 | |
| D. | 2H2(g )+2 Cl2 (g )═4HCl (g);△H=-369.2kJ•mol-1 |
| A. | 用1g98%的浓硫酸加4g水配制成19.6%的硫酸 | |
| B. | 配制一定物质的量浓度的硫酸溶液时,定容后,塞好塞子倒转摇匀后,发现液面低于刻度线 | |
| C. | 10%的硫酸和90%的硫酸等体积混合配制50%的硫酸溶液 | |
| D. | 质量分数为5x%和x%的两种氨水等体积混合配制成3x%的氨水 |
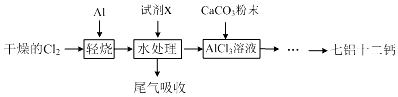
(1)轻烧后的气体用水处理前导气管为何要保温?为了防止AlC13蒸气凝华堵塞导气管
(2)用水处理添加的试剂X是盐酸,其目的是抑制铝离子水解.
(3)AlC13溶液溶解CaCO3时,要控制碳酸钙和AlC13的量,要求n(CaCO3):n(A1C13)>12:14,其原因是氢氧化钙微溶于水,造成损失.用氨水沉淀、过滤后的滤液主要成分是NH4Cl(少量CaCl2).
(4)以工业碳酸钙(含有少量A12O3、Fe3O4杂质)生产二水合氯化钙(CaC12•2H2O)的方法为:将工业碳酸钙溶于盐酸,加入双氧水,加入氢氧化钙,搅拌,用pH计调节溶液的pH为4.7,过滤.(实验中需用到的试剂和仪器有:盐酸,双氧水,氢氧化钙,冰水,pH计).
已知:几种离子生成氢氧化物沉淀pH(开始沉淀的pH按金属离子浓度为1.0mol/L计算)
| 开始沉淀的pH | 完全沉淀的pH | |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.5 | 4.7 |
| A. | 外观澄清 | B. | 丁达尔效应 | ||
| C. | 胶体在一定条件下能稳定存在 | D. | 分散质粒子直径在1nm~100nm之间 |